Szulfátsav - csoportelemeken keresztül - nemfém elemek és vegyületeik
9. Nem fémes elemek és vegyületeik. Nem-fémek
A szulfátsav H 2SO 4 a molekulaszerkezet anyaga. A kénatom hat kovalens kötést képez és +6:
A vízmentes szulfátsav nehéz olajos folyadék, szín és szag nélkül, nem olaj. Nagyon higroszkópos, bármilyen vízzel keverve. A sav vízben való feloldódását nagy mennyiségű hő felszabadítása kíséri, ezért óvatosan fel kell hígítani a vizet a vízbe, ügyeljen arra, hogy az oldatot keverje!
A H 2 SO 4 tömegaránya kevesebb, mint 70% -os savat tartalmazó oldatot nevezünk hígítottnak, és ha a tömegtömeg meghaladja a 70% -ot, koncentrálódik. Leggyakrabban a laboratóriumokban koncentrált oldatot alkalmaznak 96% -os H 2 SO 4 tömegarányban (sűrűség: 1,84 g / ml).
Kénsavas extrakció
A kénsav megszerzésének legfontosabb ipari módszere az érintkezési módszer. A megszerzés folyamata három szakaszban történik:
1. Kén (IV) -oxid előállítása pirit égetésével:
2. Kén-oxid (VIV) oxid oxidálódása kénhidrogén (VI) -oxiddá. A reakció reverzibilis, exoterm és katalitikus. A reakciókatalizátorok platina vagy vanádium (V) oxid V 2 O 5. Az optimális reakcióhőmérséklet 400-470 ° C:
3. A kén (VI) -oxid szulfátsavban történő feloldása:
Ezután vizet adunk az oleumhoz, és megkapjuk a kívánt koncentrációjú savat:
Kénsav kémiai tulajdonságai
A szulfát sav erős, kétbázisú sav. Nagy reaktivitás jellemzi. Hígított szulfátsav - erős elektrolit, a savak tipikus tulajdonságait mutatja.
1. Kétbázisú savak lépésenkénti disszociációja hidrogén-szulfát-ionok és szulfátionok képződésével:
A szulfát sav erős, az első szakaszban széteső disszociációja szinte teljesen megtörténik.
2. A hígított szulfát sav reakcióba lép a fémekkel, amelyek a hidrogén hidrogéneire helyezett szűz sorban helyezkednek el, bázikus és amfoter-oxidokkal, savas és közepes sókat képező bázisokkal, bizonyos sókkal:

A Ba 2+ és az SO 4 2- ionok kölcsönhatása a BaSO 4 fehér csapadék képződését eredményezi, amely vízben és savakban oldhatatlan.
2. A koncentrált szulfátsav erős és nem retenciós savaként kiszorítja az illó savakat sóikból:
3. 200 ° C feletti melegítés esetén a vízmentes szulfátsav részben bomlik:
4. A koncentrált szulfátsav a szerves anyagokat eltávolítja, miközben égeti őket - bomlik szénre:
5. A kénsav oxidálási tulajdonságai.
A hígított szulfát-sav gyenge oxidációs tulajdonságokkal rendelkezik a H + ionok miatt. amely a fémekkel való reakciók során megfigyelhető:
A koncentrált szulfát-sav erős oxidációs tulajdonságokat mutat fűtött állapotban. Ennek az az oka, hogy a savban lévő kénnek magasabb oxidációs állapota van - +6. A koncentrált szulfát-sav oxidálja azokat a fémeket, amelyek a szûz sorban a hidrogén bal oldalán helyezkednek el, és azokat, amelyek jobb oldalán helyezkednek el; Ebben az esetben a kén hidrogén-szulfidra, kénre vagy kén (IV) -oxiddá redukálható:
Az oxidáció mértéke, ami megszerzi a termékeket Kénvisszanyerő koncentrációjától függ kénsav és a természet a másik reagens (redukálószer): hogy egy erősebb redukálószer, amely reakcióba lép a savas, a mélyebb a visszaállítási folyamat:
a) Az alacsony aktivitású fémek (Cu, Hg, Ag) csökkentik a koncentrált szulfátsavat a kén (IV) -oxidra:
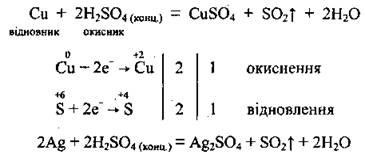
b) az aktív fémek (lúgos és alkáliföldfém) visszaállítják a koncentrált szulfátsavat hidrogén-szulfidra:
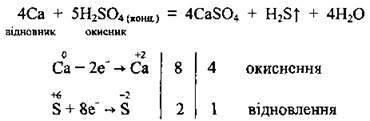
c) az átlagos aktivitású fémek (Zn, Al, Mg) a sav koncentrációjától függően egyidejűleg visszaállíthatják a koncentrált szulfátsavat különböző redukciós termékekre - kén, kén-dioxid és hidrogén-szulfid:
d) a koncentrált szulfátsav nem reagál a vasat, alumíniumot és krómot standard körülmények között. Ennek oka, hogy a fém felületén vékony oxidfilm keletkezik, amely inert a savhoz képest ilyen körülmények között. Ezt a folyamatot pasivatsiyu 1-nek nevezzük. Fűtött állapotban ezek a fémek savakká oldódnak, és a fém nagyobb oxidációs fokú sóit képezik:
Koncentrált szulfátsavval történő hevítés esetén gyakorlatilag minden fém, kivéve az arany és a platina reakcióját. A koncentrált szulfát-sav oxidálja a nemfémeket is:
A koncentrált szulfát-sav oxidálja a bromidot és a jód-ionokat szabad halogénekké, de nem tudja oxidálni a kloridionokat a C12-re. amely lehetővé teszi a HC1 sóktól történő kivonását a részvételével:
Kénsavas sók
Kétbázisú savaként a szulfátsav két só sorozatot képez: a középsőek, amelyeket szulfátoknak neveznek, és a savasak a glikogén-szulfát. A szulfátok közé tartoznak a kristályos vizet tartalmazó sók; néhányat vitriolnak neveznek.
Szulfátok kémiai tulajdonságai
1. A szulfátok a sók közös tulajdonságait mutatják: kölcsönhatás a fémekkel, bizonyos savakkal és sókkal:
2. Fűtés közben:
a) az aktív fémek (lúgos és alkáliföldfém) szulfátjai még 1000 ° C-on sem bomlanak;
b) az átlagos aktivitású fémelemek szulfátjai oxidra és kén (V) -oxidra bomlanak:
c) Cu-szulfátok. Fe. Az Al bomlik még a jelentéktelen fűtéssel is:
d) egyes fémelemek szulfátjait fém, kén (IV) -oxid és oxigén keletkezik:
Kénsav és szulfátok alkalmazása
A szulfát-savakat az ércek feldolgozása során robbanóanyagok, például gázszárító anyagok kivonására használják; ortofoszfátsav- és foszfortartalmú műtrágyák, gyógyszerek és számos szerves anyag (rostok, műanyagok, festékek) előállítása; olajtermékek tisztítására, a fémfelületek védőbevonat alkalmazása előtt; mint elektrolit az elemekben.
Magnézium-szulfát-heptahidrát MgSO 4 · 7H 2 O és nátrium-szulfát Dekaarát Na2S04 · 10H2O-t használnak az orvostudományban purgatívként.
Galuns (a Me + Me 3+ (SO 4) 2 · 12H 2 O képletû kétszeres sókat) használják az orvostudományban, valamint a textíliák festése és a bõr bõrzése során.
A gipsz és a kalcium-szulfát gyógyszert és konstrukciót alkalmazzák.
A kálium-szulfátot és az ammónium-szulfátot műtrágyákként használják.
A bárium-szulfátot papír, gumi, fehér ásványi festék, valamint az emésztőrendszer fluoroszkópiájának előállítására használják.
A réz és a vas vitriol a mezőgazdaságban a kártevők és a növényi betegségek elleni védekezésre szolgál; a festékek gyártásánál, a faanyag impregnálására (a kártevők elleni védekezésre) és fertőtlenítő anyagként.
Nátrium-szulfátot néha más nátriumsók helyett alkalmaznak az üveg és a szóda előállítása során.
1 Mivel a vasat tömény kénsavval pasziválják, azt vasállókban szállítják és tárolják.