Mivel a kémiai vegyületek úgynevezett
3 Eljárás: Cím soedineniyNazvaniya poliatomos ionos soedineniyNazvaniya kovalens vegyületek
Az a képesség, hogy nevét a fő kémiai vegyületek - a szükséges eleme a sikeres tanulmány a kémia. Kövesse ezt az útmutatót, hogy tanulni néhány alapvető szabályait elnevezési kémiai vegyületek, valamint megtanulják, hogyan kell elnevezni kémiai vegyületek, amelyek láttál először.
1. módszer 3: Cím ionos vegyületek
2. módszer 3: Names többértékű vegyületek
- 1 Határozza meg, hogy egy többértékű vegyületet. Ezek a vegyületek állnak atomcsoportok kapcsolódnak egymáshoz, az egész csoport egy pozitív vagy negatív töltést. Akkor végre többértékű vegyületek három alapvető műveleteket:
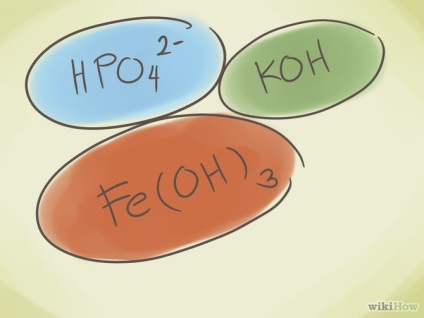
- Hozzáadása hidrogénatom a kezdődő vegyületet. Ezután az elején a vegyület nevét adjuk szó „hydro”. Ez csökkenti a negatív töltés a készüléken. Például: „karbonát” CO32- válik „hidrogén” HCO 3.

- Tisztítsa a oxigénatom a vegyület. A díjat ugyanaz marad, és a végén a vegyület neve változás „-AT”, hogy „-um”. Például: az átmenetet a NO3 NO2 - egy átmenet a „nitrát” által „nitrit”.

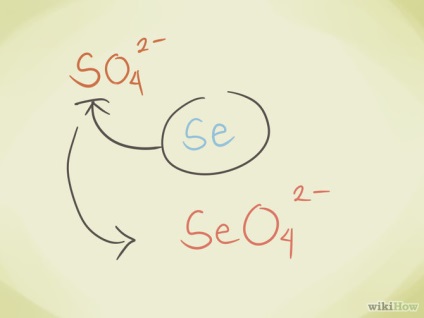
- Cserélje ki a központi atomja egy másik az ugyanazon csoporthoz a periódusos rendszer. Például, szulfát SO42 lehet szelenát SeO42-.
- Hozzáadása hidrogénatom a kezdődő vegyületet. Ezután az elején a vegyület nevét adjuk szó „hydro”. Ez csökkenti a negatív töltés a készüléken. Például: „karbonát” CO32- válik „hidrogén” HCO 3.
- 2. Megjegyzés: a közös komplex ionok. Ezek az ionok - az alapja a kialakulását a többség a nevét poliatomos vegyületek. Ezeket az alábbiakban felsorolt sorrendben növekvő negatív töltés:

- Hidroxid-ion: OH-
- Nitrát-ion: NO3
- Hidrogén-karbonát-ion: HCO 3
- Permanganát-ion: MnO4-
- Karbonát-ion: CO32-
- Kromátion: CrO42-
- Dikromát ion: Cr2O72-
- Szulfátionnal: SO42-
- Szulfition: SO32-
- Tioszulfát ion: S2O32-
- Foszfát-ion: PO43-
- ammónium-ion: NH4 +
- 3 Komponálja cím szerinti vegyületek ezen lista alapján. Keverjük össze a nevét olyan elem vagy elemek összefüggő komplex ion, és hívja kapcsolat. Ha az elem felé komplex ion, az elem neve egyszerűen behelyezhető neve után az ion.
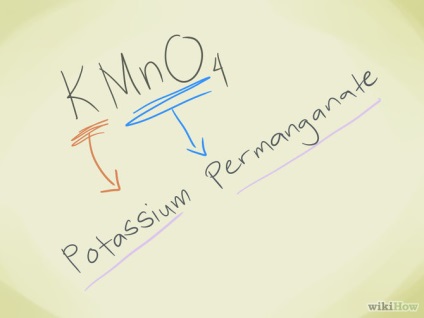
- Példa: KMnO4. Látjuk, hogy MnO4- ion - permanganát. K - a kálium, így a neve a vegyület - a kálium-permanganát.
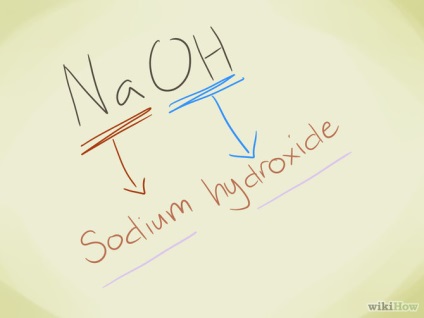
- Példa: NaOH. Látjuk, hogy az OH - a hidroxid-ionok. Na - nátrium, azonban cím szerinti vegyületek - nátrium-hidroxid.
- Példa: KMnO4. Látjuk, hogy MnO4- ion - permanganát. K - a kálium, így a neve a vegyület - a kálium-permanganát.
3. módszer A 3.: Names kovalens vegyületek
- 1 Határozza meg, hogy egy kovalens kapcsolatot. Kovalens vegyület, amely két vagy több elem-a nemfémek. A kapcsolat neve alapján az atomok számát jelen. Prefix hozzá - a latin szám, jellemzi a molekulák számát.
- 2. Ismerje előtagokat. Megjegyzés a előtagok, hogy jelezze az atomok számát 1-től 8:
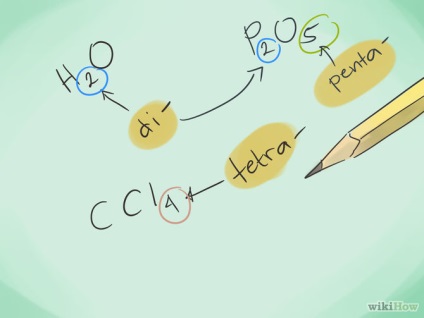
- 1 atom - "mono-"
- 2 atom - "Di"
- 3 atom - "Tri"
- 4 atom - "tetra"
- 5 atom - "penta-"
- 6 atom - "hexa"
- 7 atom - "hepta-"
- 8 atomok - "Octa"
- 3 Hívás vegyületet. A megfelelő előtagokat, hívja az új kapcsolatot. Adhat hozzá előtagot bármely részét a vegyület, amelyben több atomot.
- Példa: CO - szén-monoxid és szén-dioxid CO2.

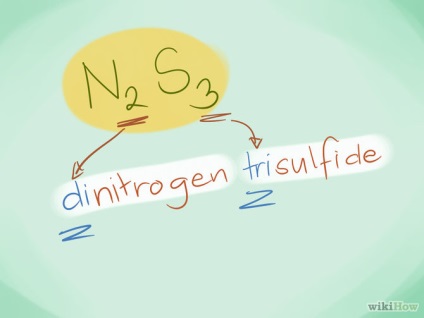
- Példa: N2S3 - ez triszulfid dinitrogén.
- A legtöbb esetben az előtag „mono” nem lehet használni, mert ez azt jelentette hiányában előtagok. Azonban, ez az előtag még ma is használják a szén-monoxid használata miatt ezt a kifejezést, mivel a korai kémia.
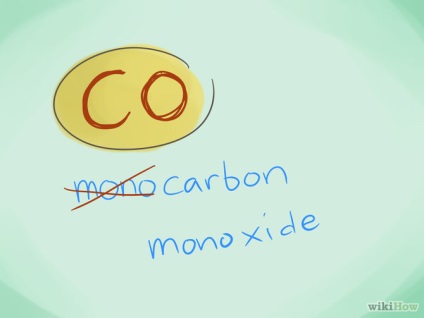
- Példa: CO - szén-monoxid és szén-dioxid CO2.
- Természetesen ezeket a szabályokat is sok a kivétel. Például, annak ellenére, hogy a CaCl2-két klóratommal, ez az úgynevezett kalcium-klorid és kalcium-NEM-diklorid, mint az egyik várnánk.
- Azt is fontos megérteni, hogy mindez nem vonatkozik a szerves kémia.
- Ezek a szabályok célja az emberek, akik elkezdték tanulmányozni a kémia és a tudomány. Amikor eléri az emelt szintű, akkor megtudjuk, hogy vannak más szabályok, mint a szabály változó vegyértékű.