Az elektródák kinetikája - tudod
AZ ELECTRODE FOLYAMATOK KINETIKAI
Az elektrolízis körülményei között, amikor az áram áthalad az elektródon, az elektródpotenciál az egyensúlyi értékhez képest változik. Ezt az elektródpotenciál változást az elektród polarizációjának vagy az elektródreakció túlfeszültségének nevezik. A polarizációt az elektrokémiai folyamatok okozzák, ezért mindig van összefüggés a folyamat sebessége és így az elektróda áramsűrűsége és a polarizáció között. Az elektrokémiai kinetika feladata az összefüggés természetének megállapítása az elektrokémiai folyamatok tudatos vezérlése érdekében.
Az elektrokémiai folyamat több egymást követő szakaszból áll: az anyag szállítása az elektród felületére, elektrokémiai redukció vagy oxidációs reakció az elektródon, valamint a reakciótermékek eltávolítása. Bizonyos esetekben fontos szerepet játszik a kémiai reakció: homogén, az elektrolitban áramlik az elektróda felületén és heterogén - az elektróda felületén. Az első esetben az elektrodába szállított anyag beletartozik az elektrokémiai reakcióba, de az elektrolitban lévő egyéb anyagokkal való bomlása vagy kölcsönhatása. Ilyen reakció előzi meg az elektrokémiai lépést. A második esetben, az elektrokémiai kibocsátás eredményeképpen nem a végső anyagot kapjuk, hanem néhány közbenső terméket, amelyet az elektród adszorbeál. Ezután az anyagnak a végtermékre való átmenet heterogén reakcióját végezzük. Néha figyelembe kell venni egy új fázis kialakulási sebességét, amely egy elektrokémiai reakció - egy szilárd kristály formájában - megjelenik. csepp fém és gázbuborék.
Attól függően, hogy ezek közül melyik szakaszok közül a korlátozó, azaz a leglassabb, az alábbi polarizációs típusokat vagy túlfeszültséget különböztetjük meg (Vetter szerint).
Az átmenet túlfeszültségét a kisülési szakasz ionizációjának lassúsága okozza. A túlfeszültség és az áramsűrűség közötti összefüggést a Tafel-egyenlet írja le:
ahol C az áramsűrűség, A / cm 2; a és b állandók. Az anódfolyamathoz
ahol k1, az elektrokémiai folyamat sebességi állandója, 1 / s; α - transzfer koefficiens (kinetikai együttható), frakció. u
Az elektrokémiai folyamatban az elektrolitban lévő ion potenciális energiája és az elektródon lévő végtermék eltérő. Az elektródreakció aktivációs energiája nem tartalmazza az energiák teljes különbségét, hanem csak egy részét. A d átadási együttható az energia ezen része és a teljes energia aránya.
A katódfolyamathoz, amelyben a potenciálisan meghatározó ionok koncentrációja (aktivitása) szerepet játszik, a Tafel-egyenlet állandói a következő értékekkel rendelkeznek:
ahol C az ionkoncentráció, mol / cm3; β - átadási együttható a katódos folyamathoz, az egységek törtrésze.
Az a és B átadási együtthatók összege egy, és általában feltételezzük, hogy α = β = 0,5.
Minden elektrokémiai (és kémiai) folyamat mind közvetlen, mind pedig hátrafelé halad. Minél tovább halad az egyensúlyi folyamat, annál inkább a közvetlen folyamat fordul elő, és fordítva. Az egyensúlyi helyzetben az előremenő és a fordított folyamatok aránya egyenlő. Az áramváltó áram és az elektrokémiai folyamat sebességét jelöli előre és hátra irányban egyensúlyi potenciál mellett. Amint a kapcsolatból következik. a váltóáram növekedésével a csomópont túlfeszültsége csökken. Ha i0 »i. akkor a túlfeszültség nullához közelít, és az eljárás egyensúlynak tekinthető (reverzibilis).
Általában az olvadt sókban lévő áramlások nagyok - egységenként több százmáspercre négyzetcentiméterenként, ami a folyamatok gyors felgyorsításához kapcsolódik magas hőmérsékleten.
Túlfeszültség diffúzió
A reagensek átvitelének késése miatt merül fel. Ez az átvitel molekuláris diffúzióval, migrációval (áttöltés a töltött részecskék - kationok és anionok elektromos mezői hatására) és a konvekció (folyadékszállítás) révén végezhető el. Általában a konvekciót az anódban felszabaduló gázok okozzák. A migrációs transzfer hatása jelentősen csökkenthető olyan háttér létrehozásával, amelyben a villamos energia átvitele más, nem kisütő ionokkal történik. Ez az átadás az alumínium elektrolizátorokban történik.
A legfontosabb korlátozó folyamat a molekuláris diffúzió, mint a leglassabb folyamat. Ha a lapos elektródon diffúzió következik be, akkor a diffúziós áram (a katódfolyamathoz) az első Fick törvényének kifejezéséből számítható ki:
ahol Co az ionok koncentrációja az elektrolit mélységében; C8 az ionok koncentrációja az elektróda felületén, -δ a diffúziós réteg vastagsága; D a diffúziós együttható.
A diffúziós réteg vastagsága az elektrolit összekeverésének körülményeitől függ - minél nagyobb az áramlatok áramlási sebessége, annál kisebb a 6 érték. Az olvadt sók elektrolízisében a diffúziós réteg vastagsága általában 0,1-1 mm.
Folyékony elektródák olvadt sók észlelték (Polyakov és mtsai.), A vastagsága a diffúziós réteg következtében csökken a Marangoni hatás: a határfelületi feszültség a fém - elektrolit más jelentése különböző részein az elektród felületén, ami a folyadék áramlását a területeken alacsonyabb határfelületi feszültség nagy területek feszültségű területekre. Ez a további keverés a nagyságrenddel csökkentheti a δ értéket.
Amikor a C koncentráció csökken, a maximális diffúziós áramot nulla értékre állítják be, az úgynevezett limitáló diffúziós áramot: id = nFDC0 / δ.
A túlfeszültség és a diffúziós áram közötti összefüggést a következő kifejezés adja:
amelyből az következik, hogy a korlátozó jelenlegi régió egy éles potenciális eltolódás negatív irányban a polarizációs görbe jelölt korlátozó jelenlegi piacon. Az elektród potenciálja tehát eltolódik, így egy másik, több elektronegatív kation (például a háttér kation) kibocsátása megkezdődik. Ha polarizációs görbe felépíteni, hogy a jelenlegi korlátot, a kapott egyenes meredekségét, amely lehetővé teszi, hogy meghatározzuk a koordinátákat igénypontban ηd -1N- (1-i / id) - elektronok száma bevont elektrokémiai reakciók.
Ha a túlfeszültséget az anód-diffúzió lassúsága határozza meg az anód kisülés alatt, a diffúziós áram és a túlfeszültség közötti kapcsolódás megfelelő egyenlete
ahol id az anionok korlátozó diffúziós áramja, A / cm 2.
A reakció túlzott mértékű kimerülése
Ezt a kémiai reakciók lassulása okozza az ionizáció előtt vagy után. Tekintsük a kibocsátás utáni heterogén reakciót, ami a legfontosabb a további bemutatáshoz.
Tegyük fel, hogy az elektrokémiai folyamat két egymást követő lépéseket tartalmazza: oxidáló anyag R: R- NE ⇄ ° C hőmérsékleten, így egy intermedier O oxidált anyag, adszorbeált az elektród felületén, a heterogén reakciót O ⇄ A., amelynél a végtermék A. Tegyük fel, hogy a kisülési lépés gyorsan folyik, gyakorlatilag egyensúlyban van, míg az ezt követő heterogén reakció lassú. A sebessége ez a lassú szakaszában áll közvetlen folyamat sebessége arányos a felület az anyag koncentrációja a O mértékben p (a sorrendben reakció), és az arány a fordított folyamat υ = υ - υ = Kč0 p - υ, ahol k - reakciósebességi állandó cm / másodperc.
Amikor ezek a folyamatok egyensúlyi sebesség: υ0 = υ = υ = Kč0 p ahol C0 - a felület anyag koncentrációja egyensúlyi mol / cm 2. Ha a folyamat nagy feleslegben A vegyületet és annak koncentrációja független a potenciál, és független C0 A reakció túlfeszültségét a következőképpen adhatjuk meg:
ahol Co az O anyag felületi koncentrációja a polarizáció alatt. Folyamat sebessége vagy áramsűrűsége
Ho nF υ0 = i0 az egyensúlyi áram sűrűsége (áramváltó áram)
A (34) és (35) kifejezések összekapcsolódnak az áramsűrűség és a túlfeszültség között:
Ha i / io »1, akkor megkapjuk a Tafel egyenletet:
A koordináták ηr - ln i ez a kapcsolat egy egyenes vonal, mint abban az esetben az átviteli feszültség, hanem együttható úgy tűnik, heterogén kémiai reakció érdekében, p és az együttható b egyenlet Tafel lesz lényegesen kisebb.
2. A katódfolyam mechanizmusa
A katód eljárás a következő, egymást követő lépéseket: a szállítás oxifluorid és fluoridot tartalmazó komplexek alumínium ionokkal, a mélység az olvadék a katód; a komplexek bomlása kettős rétegben, az Al 3+ szabadionok képződésével. és az Al 3+ ionok kisülése. Nem zárható ki, hogy a kisülési folyamat közvetlenül a komplex ionokból következik be, megkerülve a bomlásuk szakaszát. Amikor alumíniumoxid kinyerési kriolit-timföld-on olvad közömbös katód (például volfrám-) polarizációs görbéket detektált két helyen (Antipin), amely megfelel a két folyamat: Al 3+ + 2e = Al, Al + e = Al. Ha a katód folyékony alumínium. Nem töltési folyamat, mint az alumínium jelenlétében gyorsan létre az egyensúly kialakulását az ion Al 3+. Al + és fém.
Impedancia mérések, azaz az alumínium-kriolit-alumínium-oxid olvadékelektróda komplex ellenállásának vizsgálata egy váltakozó áramkörben
a frekvenciától függően lehetővé tette számunkra, hogy megbecsüljük a rendszer áramváltó értékét. Kiderült, hogy a csere a jelenlegi elektrolízis hőmérsékleten körülbelül 20 A / / cm 2. m. E. alumínium elektróda lényegében reverzibilis átmenet és törzs csak néhány mV. Ezek a mérések jelezték a túlfeszültség diffúziós jellegét.
Tanulmányok alumínium elektróda polarizációs laboratóriumi cellában (STS, stb) olyan körülmények között, ahol az anódos eljárás korlátozódott alumínium oldódás (t. E. Az anód gáz nem elkülönített), és a keverést a anolit és a katolit minimális volt azt mutatta, hogy polarizációs görbék pad limit (17. ábra, I. görbe).
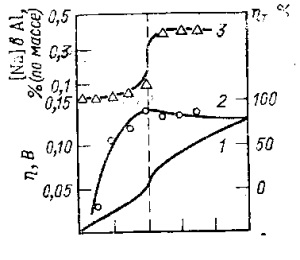
A közel katódréteg növekvő áramsűrűségével csökken az Al 3+ kationokat tartalmazó komplex oxifluorid és fluoridionok koncentrációja. és nő a Na + ionok koncentrációja. Mivel reverzibilis elektród (túlfeszültség átmenet hiányzik), a koncentráció a Na + ionok megnövelik növekedéséhez vezet a nátrium-tartalom az alumínium és a potenciális eltolódás negatív irányban. Következésképpen, van egy közös kisülési timföld és nátrium-ionok, nem csak a nátrium-szabadul egy külön fázisban (injekciós üveg, légköri nyomáson), és feloldottuk az alumínium az olvadt sóban.
Így az elektrolízis minden körülményei között alumínium és nátrium együttes kisülése van, ez utóbbi általában alumínium oldatként szabadul fel. Mivel mindkét fém felszabadul egy elektródon, potenciáljuknak azonosnak kell lennie:
Polarizált esetben a katolit nátrium-fluoriddal dúsított és alumínium-fluoriddal az egyensúlyi összetételhez képest kimerült. Ezért a katód polarizációja ee. stb. koncentrációs lánc:
Itt az elektrolit és az alumínium-nátrium ötvözet az egyensúlyi elektróda összetételét mutatja az első félelemben, a második félben a polarizált,
Ed. lánc
Diffúziós potenciál a félelemek felületén:
mivel az áramot csak nátriumionok szállítják. ezért
A reakció egyensúlyi állandójának kifejezését használva
Az ipari fürdőben lévő elektrolit és fém folyamatos mozgásban van, míg a fém felületén hullámok keletkeznek. Az elektrolit és a fém mozgása hozzájárul a diffúziós túlfeszültség eltávolításához, és az alumíniumelektród gyakorlatilag egyensúlyban van.
Az alumínium-nátrium elkülönítését elsősorban a kriolit arány és a hőmérséklet határozza meg: minél magasabbak, annál több nátriumot szabadítanak fel. A nátrium kétféleképpen hagyja el az alumíniumot: 1) feloldódik az elektrolitban, az anódba kerül és oxidálódik; 2) áthalad az alumínium vastagságán, és a szénbevonat abszorbeálja. Az első út jelentős áramveszteséghez vezet, és a jelenlegi teljesítmény csökkenéséhez vezet, a második pedig az elektrolizátorok szénbélésének korai elpusztításához vezet.