Technikai típusú cellulóz-nitrátok keresése
A cellulóz-nitrátok (NC) a nitrát-cellulózporok és szilárd tüzelőanyagok energia- és szerkezeti alapja.
A cellulóz-nitrátokat cellulóz- és salétromsav-észtereknek nevezzük. A termelés cellulóz-nitrát alkalmazott cellulóz beleesik a gyapot, a fa, a len, a szalma és így tovább. P. mennyiségben 92-93% (gyapot) és 50-60% (fa). A kiváló minõségû nitrocellulóz elõállításához speciális kémiai kezeléssel az e nyersanyagból nyert tiszta cellulózt használják.
A cellulóz molekula nagyszámú azonos és egymáshoz kapcsolódó C6H10O5 glükózmaradékból áll.
Ezért a cellulóz általános képletének formája (C6H10O5) n, ahol n a glükózmaradványok száma.
Mindegyik glükózmaradékban három hidroxilcsoport van - OH. Ezek a hidroxilcsoportok a savatartalmú salétromsavval reagálnak:
,
ahol m = 1; 2 vagy 3.
A nitrálás körülményeitől függően nem minden hidroxilcsoport helyettesíthető, csak egy részük. Emiatt nem csak egy, hanem különböző észterezési fokú nitrocellulózokat is kapunk.
A cellulóz szerkezete nem fejezhető ki semmiféle definícióval, mert molekulaméretben inhomogén. Ez még inkább a cellulóz-nitrátokra vonatkozik, amelyek az észterezés mértékében heterogén molekulákat is magukban foglalnak. cellulóz-nitrátok függően a nitrogéntartalom (észterezési fok), oldhatósága spirtoefirnoy keverék és a polimerizációs fok majdnem besorolása a következő típusok: robbanógyapot № 1, robbanógyapot № 2 vegyes robbanógyapot jelöli a BA, CA, NA, pirokollody és kollódiumban különböző márkák : Н, ВНВ, ПСВ, КП
13. Piroxilin gyöngyök, amelyeket n. Miért nem használják ugyanazt a típusú piroxilint, a colloxilint? Megmagyarázni.
A cellulóz szerkezete nem fejezhető ki semmiféle definícióval, mert molekulaméretben inhomogén. Ez még inkább a cellulóz-nitrátokra vonatkozik, amelyek az észterezés mértékében heterogén molekulákat is magukban foglalnak. cellulóz-nitrátok függően a nitrogéntartalom (észterezési fok), oldhatósága spirtoefirnoy keverék és a polimerizációs fok majdnem besorolása a következő típusok: robbanógyapot № 1, robbanógyapot № 2 vegyes robbanógyapot jelöli a BA, CA, NA, pirokollody és kollódiumban különböző márkák : Н, ВНВ, ПСВ, КП.
A 2. piroxilén teljes mértékben megduzzad az alkohol-észter keverékben, és részben folyékony oldatot képez. Piroxilin № 1 csak részben megduzzad egy oldószerben, de mivel közötti szolvatált részecskék robbanógyapot № 2 válik mozgatható, t. E. Guncotton № 1 és 2 guncotton № kölcsönhatásba nem csak az oldószerrel, hanem egymással. Megállapítottuk, hogy a 2. számú oldott piroxil-származék hatékonyabb lágyítószer az 1-es piroxilinnek, mint az alkohol-észterkeverék.
A HC oldhatósága az a HC mennyisége, amelyet az oldatba átalakítunk (1 g) 150 ml alkoholészter-keverékkel való kezelésével,
komponens aránya 1: 2 (térfogatarány).
A vegyes piroxilin oldhatóságának csökkentése a 2. számú piroxil-tartalom csökkenése következtében az oldószer-fogyasztás csökkenéséhez vezet. Ugyanakkor a keverékben lévő 2-es számú piroxilintartalom nagyon alacsony, az oldószer fogyasztása szintén növekszik. Ennek az az oka, hogy az 1. számú piroxilint gyengén lágyítjuk egy alkohol-észter-keverékkel, ezért szükség van az alkoholészter-keverék aktivitásának növelésére az éter tartalmának növelésében.
Browns szerint a közepes nitrogén-piroxilinek, amelyeknek oldhatósága körülbelül 40%, a legjobb plaszticitással rendelkeznek ugyanabban az oldószer-fogyasztásban.
A vegyes piroxilinek duzzadásának fő szerepe a 2. piroxilinnel játszott. A piroxilinnek 2-es magatartását meghatározó fő paraméterek a nitrálás foka.
Cellulóz-nitrát lágyítók. Ha cellulóz nitrátok voltak képesek tömörítjük, hogy a sűrűsége 1600-1670 kg / m3 (1,60-1,67 g / cm3), és a formázott, nyomás alatt a szóban forgó, a por készülhet egyetlen komponens - a cellulóz nitrátok. Ez azonban lehetetlen. Ennek oka a cellulóz-nitrátok plaszticitási tulajdonságainak hiánya.
Ezek szilárd rostszerkezet, morzsalékos, egy nagyszámú makro - és mikro üregeket töltve levegővel, és áll egy kemény poláros makromolekulák összekapcsolódva igen szilárdan különböző erők (Interpacket és intermolekuláris) és nem képesek a kilátás az elmozdulás egymáshoz képest. Még a magas hőmérsékleti tartományban sem termoplasztikusak, és üvegesített állapotban vannak.
A makromolekulák teljes hosszúsága közötti teljes kötési energia nagymértékben meghaladhatja a lánc egyes láncai közötti kötési energiát. Ezért egy molekula elszakadása a másiktól olyan nehéz, mint a makromolekulák különálló kapcsolatokká való megtörése.
Az NC intermolekuláris kölcsönhatásának energiája összértéke jóval magasabb, mint a lánc makromolekulák és a láncmolekulák szegmenseinek hőátviteli energiája. Amikor fűtött, NC megsemmisítése kémiai kötések előtt történik a teljes gyengülése a másodlagos (és Interpacket intermolekuláris) kötvények lesz elegendő ahhoz, hogy a feltételeket a átmenet üveges anyag erősen elasztikus és viszkózus állapotban.
Azt tapasztaltuk, hogy az öntőprésekben az NC nyomása, hőmérséklete vagy kezelési ideje nem vezet műanyag állapotba. Ezért annak érdekében, hogy az NC olyan tulajdonságokat adjon meg, amelyek a külső deformáló erők hatására meghatározzák annak folyékonyságát, azokat módosítani kell.
Az NC egyik módja a lágyítás. Különböző folyadékok és szilárd anyagok (lágyítók) bevezetését jelenti a polimerben a feldolgozás elősegítése, valamint az anyag rugalmasságának javítása és fagyállósága érdekében.
A lágyítás során a rendszer viszkozitása megváltozik, a makromolekulák rugalmassága nő és a supramolekuláris szerkezetek mobilitása nő. A colloxylinek, a pirokollód, a piroxil-N2, a piroxilinek keveréke jó lágyítószer etil-alkohol és dietil-éter elegye. Meg kell jegyeznünk, hogy az etil-alkohol és a dietil-éter külön nem az NC lágyítói.
A leghatékonyabb lágyítószer az összes NC-ből (a kolloxilinekről a piroxilénekre) a legmagasabb észterezési fokú aceton és etil-acetát. A nitroglicerin és a nitrodiglikol jó lágyítószerek a kolloxilinnek. További lágyítók dinitro-toluol, dibutil-ftalát.
Amikor adunk piroxilin megfelelő mennyiségű spirtoefirnoy keveréket kapott tömeget, amely könnyen deformálódik külső erők, de miután a terhelés megszüntetése, hogy az eredeti állapot nem tért vissza, a T. E. A rendszerben van egy nagy maradó alakváltozás miatt képlékeny, amely ismert , mindig bonyolult a nagy rugalmasságú deformáció kialakulása.
15) A legfontosabb az egyszerű, dietil-éter. amelynek képlete a következő alakú: (C2H5) 20 vagy C4H10O. Színtelen, átlátszó, rendkívül mozgékony illékony folyadék, amelynek sajátos illata és égő íze van. A fény, a levegő, a hő és a nedvesség hatására az éter bomlik le, ami mérgező aldehideket, peroxidokat és ketonokat képez, amelyek irritálják a légzőrendszert. 20 fokos vízhőmérsékleten 6,5% -kal oldódik. Jól illeszkedik zsíros és illóolajokhoz, benzolhoz és alkoholhoz, függetlenül az aránytól. Maga az éter azonban, mint a pára, könnyen meggyullad. Bizonyos arányban oxigénnel vagy levegővel az anesztézia során használt dietil-éter-párok robbanásveszélyesek
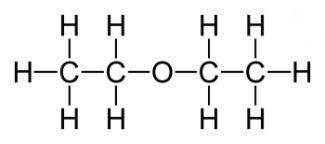
Kémiai tulajdonságok A dietil-étert az éterek kémiai tulajdonságai jellemzik. Így részletesebben foglalkozunk ezzel a kérdéssel. Ez egészen inert anyag. Az észterek fő különbsége a hidrolízis hiánya, azonban vannak kivételek. Hidegen nem reagál a foszfor-kloriddal, a fémes nátriummal és sok híg ásványi savval. Ennek ellenére, az erős savak (kénsav és a hidrogén-jodid), még alacsony hőmérsékleten, ezek az észterek elbomlanak, és melegíti fémnátrium hasítja őket. Észtert magános elektronpár kölcsönhatásba lép a proton egy erős sav, ezáltal egy instabil oxónium-vegyület: - acidolízissel. A kénsavat és a hidrogén-jodid, és FeCl3 ecetsavanhidridben hasítására képes éterek. A kémiai reakció a következő: CH3-CH2-O-CH 2-CH 3 + HJ → CH3-CH2-OH + J-CH2-CH3. - A fémezés reakciója, a Shorygin reakciónak nevezik. A fűtött fémnátrium hasítja dietil-éter: C2H5-O-C2H5 + 2Na → C2H5ONa + C2H5Na - relatív kémiai semlegesség nem akadályozza az észtereket tárolás során a levegőtől peroxidokat képez, ami gyakran vezet a robbanások végén desztillációval.
Dietil-éter: fizikai tulajdonságok furcsa szaga, alacsony forráspontú éterek - bizonyíték a gyenge intermolekuláris hatással, és ez azt jelzi, alacsony polaritású és távollétében előfeltételei a hidrogén kötések kialakulását. Az alkoholokkal ellentétben az észterek erősebb elektrondonáló tulajdonságokkal rendelkeznek, amit az ionizációs potenciál értéke is alátámaszt. Ezeknek a tulajdonságoknak a javítása az alkánokból kapott atomok csoportjának a hidrogénatom eltávolítása után kapott pozitív induktív hatásának köszönhető.
A dietil-éter forráspontja 35,6 Celsius fok (ez jóval alacsonyabb, mint az izomer alkoholoké), és a fagyáspont 117 oC. Az éterek szinte nem keverednek a vízzel. Ennek magyarázata meglehetősen egyszerű: nem képes hidrogénkötéseket alkotni, mivel molekuláik nem rendelkeznek poláris kötésekkel. Vízben és dietil-éterben gyengén oldódik, amelynek sűrűsége a hidrogén-oxidra nézve 0,714. A szóban forgó anyag egyik jellemzője a villamosítási hajlam. A statikus elektromosság kibocsátásának valószínűsége különösen magas a kémiai összetétel transzfúziójával vagy kisülésével, aminek következtében gyulladás fordulhat elő. Az aero-gőz levegővel formálódik, ami 2,5-szer könnyebb, robbanásveszélyes keverékek. Az alsó robbanási határ 1,7%, a felső határ pedig 49%. Az éterrel való munka során nem szabad megfeledkeznünk arról, hogy a pároknak az a tulajdonságuk, hogy nagy távolságokat teremtsenek az égési képesség elvesztése nélkül. Tehát a fő elővigyázatosság a nyílt tűz és más gyújtóforrások hiánya. Éter - alacsony aktivitású vegyület, időnként kevésbé reaktív, mint az alkoholok. Meglepő módon feloldja a legtöbb szerves anyagot, ami miatt oldószerként használják. A dietil-éter nem kivétel. A fizikai tulajdonságok, valamint a kémiai tulajdonságok lehetővé teszik, hogy az orvostudományban és a gyártásban használatos legyen
A dietil-éter előállítása Az étereket nem találjuk a természetben, hanem szintetikusan nyerik őket. A savkatalizátorokat etil-alkohollal emelt hőmérsékleten befolyásolva dietil-étert kapunk (a fentiekben megadott képlet). Ennek az anyagnak a legegyszerűbb módja a kénsavból és alkoholból álló keverék desztillálásával. Ehhez 140-150 Celsius fokot kell felmelegíteni. Szükségünk lesz etil-alkoholra és kénsavra (egyenlő arányban), pipettákkal, kémcsövekkel és gázvezetékekkel. Tehát a berendezés és a reagensek elkészítése után elkezdheti elvégezni a kísérletet. Egy kémcsőben (szükségszerűen száraznak kell lennie), 2-3 ml alkohol és sav keverékét kell lassan felmelegíteni. Amint a forralás elkezdődik, az égőt eltávolítják, és 5-10 csepp etil-alkoholt adnak a forró keverékhez egy cső segítségével a cső falán. Az áramló reakció a következő: CH3-CH 2-OH (etil-kénsav) + H2S04CH3-CH2-OSO3H + H20; CH 3-CH 2-OSO 3H + CH 3-CH 3-0; CH3-CH2-0-CH2-CH3 (dietil-éter) + H2S04. A dietil-éter képződését a megjelenő illat igazolja.
Összetétel és képlet Az etanol - pontosan az egyik hivatalos neve egyaránt - egyszerű alkoholokra utal. Szinte mindenki ismeri az egyik vagy másik név alatt. Gyakran egyszerűen alkoholnak nevezik, néha "etil" vagy "bor" melléknevet adnak, a kémikusok metil-karbinolnak is nevezik. De a lényeg egy - C2H5OH.
Fizikai és kémiai tulajdonságok Az etanolnak az alkohol általános jellemzői és reakciói vannak. Színtelen, jellegzetes íz és illata van. Normál körülmények között folyékony, szilárd alakú, -114 ° C hőmérsékletű, és +78 ° C-ra forrunk. Az etil-alkohol sűrűsége 0,79. Jól keveredik vízzel, glicerinnel, benzollal és sok más anyaggal. Könnyen elpárolog, ezért jól lezárt tartályokban kell tárolni. Maga kiváló oldószer, és kiváló antiszeptikus tulajdonságokkal rendelkezik. Nagyon tűzveszélyes mind folyékony, mind gőzállapotban. Az etanol pszichoaktív és narkotikus anyag, ez része az összes alkoholtartalmú italnak. Egy halálos dózis egy felnőtt számára 300-400 ml 96% -os alkoholtartalmú oldat egy órán át. Ez a szám meglehetősen önkényes, mivel számos tényezőtől függ. Gyermekeknek már elég 6-30 millilitert. Tehát az etanol elég hatékony méreg. Ennek ellenére széles körben használják, mert számos olyan egyedi tulajdonsággal rendelkezik, amelyek egyetemessé teszik
A dietil-éter előállítása Az étereket nem találjuk a természetben, hanem szintetikusan nyerik őket. A savkatalizátorokat etil-alkohollal emelt hőmérsékleten befolyásolva dietil-étert kapunk (a fentiekben megadott képlet). Ennek az anyagnak a legegyszerűbb módja a kénsavból és alkoholból álló keverék desztillálásával. Ehhez 140-150 Celsius fokot kell felmelegíteni. Szükségünk lesz etil-alkoholra és kénsavra (egyenlő arányban), pipettákkal, kémcsövekkel és gázvezetékekkel. Tehát a berendezés és a reagensek elkészítése után elkezdheti elvégezni a kísérletet. Egy kémcsőben (szükségszerűen száraznak kell lennie), 2-3 ml alkohol és sav keverékét kell lassan felmelegíteni. Amint a forráspontja, az égő eltávolítjuk, és a forró elegyet pipettáztunk a fal mentén a csövek adunk 5-10 csepp etanolt. Az áramló reakció a következő: CH3-CH 2-OH (etil-kénsav) + H2S04CH3-CH2-OSO3H + H20; CH 3-CH 2-OSO 3H + CH 3-CH 3-0; CH3-CH2-0-CH2-CH3 (dietil-éter) + H2S04.