Az ammónia nagy szovjet enciklopédia
Ammónia, NH3. a nitrogén legegyszerűbb kémiai kapcsolata hidrogénnel. A vegyipar egyik legfontosabb terméke; szintézise az ammónia a nitrogén levegő és hidrogén - a fő módja annak, hogy az úgynevezett. kötődő nitrogén. Természetben az ammónia a nitrogéntartalmú szerves anyagok bomlásával jön létre. Az "ammónia" név - rövidítve a görögről. hals ammoniakos vagy lat. sal ammoniacus; úgynevezett ammóniát (ammónium-klorid), amelyet a líbiai sivatagban az ammónium (most Siva) oázisában kaptak.
Fizikai és kémiai tulajdonságok. Az ammónia színtelen gáz, éles szagú és éles ízű. A sűrűsége gázalakú ammóniával 0 ° C-on és 101,3 kN / m 2 (760 mm Hg. V.) 0,7714 kg / m 3. A forráspont -33,35 ° C -77,70 ° C olvadáspont, tkpit 132 4 ° C-on, a kritikus nyomása 11,28 MN / m 2 (115,0 kg / cm 2), a kritikus sűrűség 235 kg / m 3. a hő párologtatás 23,37 kJ / mól (5,581 kcal / mol). Az ammónia és a levegő száraz keveréke felrobbanhat; A robbanás határa szobahőmérsékleten 15,5-28% ammónia tartományban van. A hőmérséklet növekedésével a határok kibővülnek. Az ammónia vízben könnyen oldódik (0 ° C-on a víz térfogata kb. 1200 térfogat ammóniát, 20 ° C-on - 700 térfogat ammónia felszívódik). 20 ° C-on és 0,87 MN / m 2 (8,9 kgf / cm 2) könnyen átalakulhat az ammónia, színtelen folyadék, melynek sűrűsége 681,4 kg / m 3. határozottan megtöri a fényt. Mint a víz. A folyékony ammónia erősen kötődik, főleg a hidrogénkötések kialakulásának köszönhetően. A folyékony ammónia gyakorlatilag nem vezet áramot. A folyékony ammónia jó oldószer nagyon sok szerves vegyület, valamint sok szervetlen vegyület esetében. Szilárd ammónia - színtelen köbös kristályok.
Az ammónia molekula szabályos trigonometrikus piramis, amelynek csúcsán N atom található; szögek a H-N-H kötések között 108 °, interatomikus távolságok H-N-H 1.015, H-H 1.64.
Az ammónia molekulák érdekes tulajdonsága a strukturális inverzióra való képességük. vagyis a "kifelé fordulni" a nitrogénatomnak a hidrogénatomok által alkotott piramis alapja síkján keresztül történő áthaladásával. Az inverzió összefüggésbe hozható egy szigorúan meghatározott frekvenciájú sugárzással, amely alapján nagyon pontos idő meghatározásra szolgáló berendezést (molekuláris generátorok) hoztak létre. Az ilyen "molekuláris órák" lehetővé tették különösen annak megállapítását, hogy a földi napok időtartama évente 0,43 msec-kal nő. Az ammónia-molekula dipólus pillanata 1,43D. A páratlan elektronok hiánya miatt az ammónia diamágneses.
Fogadás és alkalmazás. A laboratóriumi körülmények között, az ammónia úgy állíthatjuk elő elmozdulása erős lúgok ammóniumsók séma szerint: 2NH4 CI + Ca (OH) 2 = 2NH3 + CaCl2 + 2H2 O. A legrégebbi ipari előállítására szolgáló eljárás az ammónia - szétválasztását a füstgázokból a szenet kokszoló. A főbb ipari gyártására szolgáló eljárás egy modern ammónia - szintézisét az elemek - nitrogén és hidrogén. 1908-ban a német chemist F. Haber javasolta.
Az ammónia szintéziséhez szükséges folyamatgáz előállításának legáltalánosabb és gazdaságosabb módja a szénhidrogéngázok átalakítása. A kiindulási anyag ebben a folyamatban földgáz. valamint a kapcsolódó kőolaj-gázok. finomító gázok. acetilén termelés maradék gázai. A nitrogén-hidrogén-keverék előállítási eljárásának lényege, hogy a metán és homológjainak magas hőmérsékleten hidrogéngáz és szén-monoxid bomlik oxidálószerek, vízgőz és oxigén segítségével. Légköri levegőt vagy levegőt adunk az átalakított gázhoz. oxigénnel dúsított. Az egyszerű anyagokból származó ammónia szintézise
a hőkibocsátással és a térfogatcsökkenéssel áramlik. A legkedvezőbb az egyensúly szempontjából. az ammóniaképzés feltételei lehetnek az alacsonyabb hőmérséklet és esetleg a magasabb nyomás. Katalizátorok nélkül az ammónia szintézisének reakciója egyáltalán nem fordul elő. Az iparban az ammónia szintéziséhez csak vaskatalizátorokat használnak. melyet Fe3O4 kondenzált vasoxidok aktiválásával (Al2O3, K2O, CaO, SiO2 és néha MgO) redukálunk. A szintézis során a gázkeverék katalitikus mérgek tisztítása (ezek közé tartoznak az S, O2, Se, P, As, vízgőz, CO stb.).
A szintetikus ammónia előállításának módszerei különböznek az alkalmazott nyomástól. rendszer alacsony (10-15 MN / m 2), közepes (25-30 MN / m 2) és magas (50-100 Mk / L 2) nyomás. A leggyakoribb közepes nyomású rendszerbe (30 MN / m 2 és 500 ° C) (1 MN / m 2 (10 kgf / cm 2), amely növeli a gáz használatának a modern ammónia szintézis rendszerek alkalmazott többszörös forgalomban nitrogén-hidrogén keverékben, -. Circular ammóniás (lásd az ábrát).
Friss gáz (nitrogén-hidrogén keverék) és nem reagált, úgynevezett. a keringtetett gázok először bejutnak az 1 szűrőbe, ahol szennyeződést tisztítanak, majd a 2 kondenzációs oszlop héttérbe, és felmelegítik a hőt a gázra. az oszlop csövek mentén mozognak. Ezután a gázok áthaladnak a 3 párologtatón, ahol további hűtő és ammónia kondenzáció következik be. a keringő gázok által szállított. A lehűtött elegyet kondenzáljuk gázok és ammóniát az elpárologtató vannak irányítva egy választótölcsérbe része (szeparátor) kondenzációs oszlopon, ahol a folyékony ammóniát elválasztjuk, és mint késztermék lemerült csövön keresztül a tartályba 9. A gáz alakú ammóniát. elhagyva az elpárologtatót. a 4 fröccsöngyön keresztül áthaladva a folyékony ammónia cseppjeiből felszabadul és a cseppfolyósítóhoz vagy a hűtőegységbe kerül. Gázában. mentes az ammóniától. az elválasztóból a szintézis 5 oszlopba jut. A belső szintézis oszlop egy csőszerű vagy polcos fúvókával és hőcserélővel ellátott katalizátor doboz. Gázában. átjutnak a szintézis oszlopon, reagálnak egymással; Az oszlopot elhagyó gázkeverék 15-20% ammóniát tartalmaz. Továbbá, ezek a gázok belépnek a kondenzátor 6, ahol az ammónia elfolyósodik Folyékony ammóniát elválasztjuk a 7 elválasztó, és tápláljuk a tartály 9, és az el nem reagált gáz 8 keringtetőszivattyú a szűrőt 1 keverésére friss nitrogén-hidrogén keverék.
Az ammónia salétromsav előállítására szolgál. nitrogéntartalmú sók. karbamid. pruszsav. ammónia módszerrel. Mivel a folyékony ammóniának nagy a párolgása. akkor. a hűtőgépek munkaanyagaként szolgál. Folyékony ammóniát és vizes oldatait használják folyékony műtrágyákként. Nagy mennyiségű ammóniát alkalmaznak a szuperfoszfát és a zsírkeverékek ammóniaira.
Az ammónia mérgező. Erősen irritálja a nyálkahártyákat. Akut mérgezés ammónia esetén károsítja a szemet és a légutakat, légszomjat, tüdőgyulladást. Az ipari létesítmények levegőjének ammónia megengedett legnagyobb koncentrációja 0,02 g / m 3. Az ammóniát acélhengerekben tárolják. sárga színű, fekete feliratú ammónia.
Irod A kötött nitrogén technológiája. M. 1966.
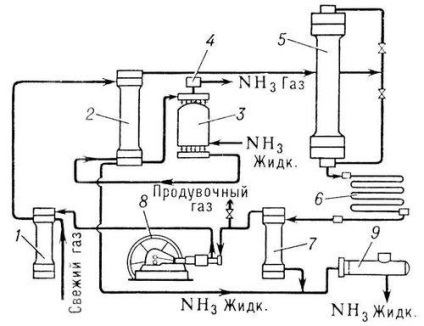
Ammónia szintézis egység (folyamatáramdiagram).
