Kivonat fehérjék - banki kivonatok, esszék, beszámolók, dolgozatok, disszertációk
Aminosavak - belkov.Belki szerkezeti elemek, vagy a fehérjék (a görög protos szabja meg -. Paramount), - biológiai heteropolimerek amelynek monomerek aminosavak.
Az aminosavak kis molekulatömegű szerves vegyületet tartalmaz, amelynek karboxil (-COOH), és amino- (-NH2) csoportokat, amelyek kötődnek ugyanahhoz a szénatomhoz. A szénatom az oldallánc kapcsolódik - egy radikális biztosító konkrét tulajdonságait az egyes aminosavak. Az általános képletű aminosavak a következő:
A legtöbb aminosav egy karboxilcsoportot és egy amino-csoport; Ezek az aminosavak nevezzük semleges. Van azonban, esszenciális aminosavak - több mint egy aminocsoport, valamint savas aminosavakkal - egynél több karboxilcsoportot.
Jelenleg mintegy 200 aminosavból az élő szervezetben, de csak 20 közülük része a fehérje. Ez az úgynevezett alap- vagy belokobrazuyuschie (proteinogén) aminosavak.
Attól függően, hogy milyen típusú a radikális bázikus aminosavakat három csoportra oszthatók: 1) nem-poláris (alanin, metionin, valin, pro-ling, leucin, izoleucin, triptofán, fenil-alanin); 2) töltés nélküli poláros (aszparagin, glutamin, szerin, glicin, tirozin, treonin, cisztein); 3) poláros töltött (arginin, hisztidin, lizin - pozitív; aszparaginsav és a glutaminsav - negatív).
Oldalláncai aminosavak (radikális) lehet hidrofób vagy hidrofil, amely a megfelelő tulajdonságait fehérjék, amelyek megmutatkoznak az kialakulását szekunder, tercier és kvaterner fehérje szerkezetét.
A növényekben az összes szükséges aminosavat szintetizálódnak elsődleges termékeket a fotoszintézis. Az ember és az állatok nem képesek szintetizálni egy sor proteinogén aminosavak és meg kell kapnia azokat kész formában étellel. Ezek az aminosavak az úgynevezett esszenciális. Ezek közé tartozik a lizin, valin, leucin, izoleucin, treonin, fenil-alanin, triptofán, metionin; atakzhe arginin és a hisztidin - nélkülözhetetlen a gyermekek számára,
Az oldatot, az aminosav szolgálhat mind savak és bázisok, t. E. Ezek amfoter vegyületek. A karboxil-csoport -COOH képes protont, működik, mint egy sav, és amin - NH2 - fogadja egy proton, ezáltal mutatva egy bázis tulajdonságai.
Peptidek. Az aminocsoport egy aminosav képes reagálni a karboxilcsoporttal egy másik aminosav.
A kapott molekula tehát egy dipeptid, egy -CO-NH- kötés nevezzük peptidkötés:
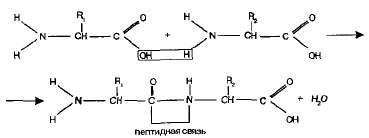
Egyik végén a molekula a dipeptid szabad aminocsoport, míg a másik - a szabad karboxilcsoport. Emiatt dipeptid, hogy vegye át a többi aminosav, képző oligopeptidek. Ha igen kötve sok aminosavat (több mint tíz), kiderül polipeptid.
Peptidek fontos szerepet játszanak a szervezetben. Sok oligo és polipeptid hormonok, antibiotikumok, toxinok.
Oligopeptidek oxitocin, vazopresszin, tirotropin, és a bradikinin (peptid fájdalom), és egyes opiátok ( „természetes drogok” személy), feladatának a fájdalom kezelésére. Elfogadása a hatóanyag elpusztítja az opioid rendszer a szervezet, így a drogfüggő nélkül egy adag a gyógyszer nagy fájdalmai - „break-up”, amelyet általában eltávolítjuk opiátok. Bizonyos oligopeptidek közé tartoznak az antibiotikumok (például, gramicidin S).
Számos hormon (inzulin, adrenokortikotrop hormon, stb,), antibiotikumok (például gramicidin A), toxinok (például diftéria toxin), olyan polipeptidek.
A fehérjék polipeptidek, amelyek tartalmaznak egy molekula ötven több ezer aminosavból relatív molekulatömege több, mint 10 000.
A szerkezet a fehérjék. Mindegyik fehérjéből egy adott környezetben sajátos egy adott térbeli szerkezetet. A jellemző térbeli (háromdimenziós) struktúrát van osztva négy szintjét szervezésének fehérjemolekulák (ábra. 1,1).
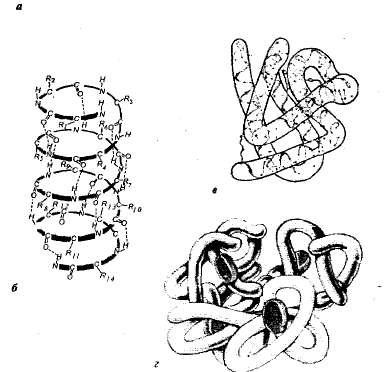
Ábra. 1.1. Fehérje szintjét a strukturális szervezet: egy - elsődleges szerkezete - belkaribonukleazy aminosav-szekvenciát (124 aminosav egység); b - a másodlagos szerkezetet - poyaipeptidnaya lánc csavart egy hélix; a - a harmadlagos szerkezetét a fehérje mioglobin; g - kvaterner szerkezetét hemoglobin.
Az elsődleges szerkezet - a szekvencia az aminosavak a polipeptid-láncban. Egy ilyen szerkezet specifikus minden egyes fehérje és határozza meg a genetikai információ, azaz. E. Függ a nukleotidszekvencia részét kódoló DNS-molekula az aktív fehérje. Az elsődleges szerkezet függ az összes tulajdonságai és funkciói a fehérjék. Helyettesítése egyetlen aminosav a fehérje-összetételét molekulák, vagy megsérti a sorrendben azok elrendezése általában magában foglalja a változás a fehérje funkcióját.
Tekintettel arra, hogy része a fehérje tartalmaz 20 féle aminosav, a variánsok száma a kombinációt a polipeptid lánc valóban végtelen, amely egy hatalmas különféle fehérjék az élő sejtekben. Például, több mint 10 ezer. A különböző fehérjék, és ezek épülnek azonos alapvető 20 aminosav található az emberi szervezetben.
Az élő sejtekben, fehérjemolekulák vagy specifikus részei nem lánchosszabbított és csavart egy spirál, hasonlít egy kifeszített rugó (úgynevezett A-hélix) vagy hajtogatva hajtogatott réteg (p-réteg). Az ilyen a-hélix és a p-rétegek szekunder struktúra. Ez eredményeként keletkezik a hidrogén kötések kialakulását az azonos polipeptid-lánc (spirális konfiguráció) vagy két polipeptid lánc (a hajtogatott rétegek).
Teljesen a-helikális konfigurációval rendelkezik a keratin protein. Ez egy szerkezeti fehérje a haj, köröm, karom, csőr, tollak és szarvak; ez egy része a külső réteg a bőr gerincesek.
A legtöbb fehérje és nonspiral spirális régiók a polipeptid láncok szeres háromdimenziós kialakulását gömb alakú - gömböcske (jellemző globuláris fehérjék). A gömböcske egy adott konfiguráció a harmadlagos szerkezetét a fehérje. Ez a szerkezet stabilizálódik ionos, hidrogén, kovalens diszulfid kötések (között kialakított kénatomok részét on-cystitis, cisztin és megionina) és hidrofób kölcsönhatások. A legfontosabb az eredete a harmadlagos szerkezet hidrofób kölcsönhatások; ahol a fehérje koagulál, úgy, hogy a hidrofób oldalláncok vannak elrejtve a molekulán belül, t. e. védve vízzel érintkezve, és a hidrofil oldalláncot, éppen ellenkezőleg, ki vannak téve a külső.
Számos proteint különösen bonyolult szerkezet, amely több polipeptidláncból (alegységek), alkotó kvaterner szerkezetét a fehérje molekula. Egy ilyen szerkezet például globuláris fehérje hemoglobin. A molekula négy egyedi polipeptid alegységek (promoterok) található a harmadlagos szerkezet, és a nem-fehérje része - hem.
Csak egy ilyen szerkezet, a hemoglobin képes végrehajtani a közlekedési funkcióval.
Hatása alatt a különböző fizikai és kémiai faktorok (kezelés alkohol, aceton, savak, lúgok, hő, a besugárzás, a magas nyomású, és így tovább. D.) megváltozása, a szekunder, tercier és kvaterner a fehérje szerkezetére amiatt, hogy törés hidrogénkötéseket, és ionos kötések. Process rendellenességek natív (természetes) fehérje nevezett szerkezet denaturálódását. Így oldhatósága csökken a fehérje, a változó az alakja és mérete a molekulák, az enzimaktivitás csökkenésének és így tovább. G. Denaturáló folyamat lehet teljes vagy részleges. Egyes esetekben, az átmenet a normál környezeti feltételek kíséri spontán gyógyulás a természetes fehérje szerkezetét. Ezt a folyamatot nevezik renaturáláshoz.
Egyszerű és összetett fehérjék. Szerint a kémiai összetétele izolált egyszerű és összetett fehérjék. Azáltal prostm lehetnek fehérjék, amely csak az aminosavak, és, hogy a komplex - fehérjék tartalmazó fehérje és a nem protein rész (protézis); prosztetikus csoport képezhet fémionok, foszforsav maradék, szénhidrátok, lipidek, és mások egyszerű fehérjék vér szérum albumin, fibrin, bizonyos enzimek (tripszin), stb komplex fehérjék mind glikoproteinek és proteolipid ..; Ezek komplex fehérjék, például immunglobulinok (antitestek), a hemoglobin, a legtöbb enzimek és így tovább. D.
Szerkezetét. A fehérjék része sejtmembrán és az organellumok a sejt mátrix. A falakon az erek, porc, inak, haj, köröm, karom magasabb rendű állatokban áll túlnyomórészt a fehérjék.
A katalitikus (enzimes). Fehérjék enzimek katalizálják az áramlás a kémiai reakciókat a szervezetben. Ezek biztosítják a hasítási tápanyagok az emésztőrendszerben, szén-rögzítés a fotoszintézis, és a hasonlók. D.
Transportation. Egyes fehérjék képesek csatlakozni és átadni különböző anyagok. Albumin vér közvetített zsírsav-globulin - fémionok, és a hormonok, a hemoglobin - az oxigén és szén-dioxid. Fehérjemolekulák, amelyek részei a plazmamembrán, részt vesznek az anyagok szállítását a sejtbe.
Védő. A működnek immunglobulinok (antitestek), a vér, amely az immunvédelmet. Fibrinogén és a trombin a véralvadásban szerepet játszó, és megakadályozzák a vérzést.
Összehúzódó. Miatt csúszik egymáshoz képest aktin és a miozin protofibrilekhez bekövetkezik az izom-összehúzódás, valamint a nem-izom intracelluláris csökkentésére. csillók és flagellumok mozgás kapcsolódó csúszó mikrotubulusok egymáshoz képest, amelynek protein-jellegű.
Szabályozási. Sok hormonok bedkami vagy oligopeptidek (például inzulin, glukagon, [antagonista inzulin], adrenokortikotrop hormon, és mások.).
Receptor. Egyes fehérjék ágyazva a sejtmembrán, képesek megváltoztatni a szerkezetét hatása alatt a külső környezet. Mivel a jelek kívülrõl és információtovábbítás a sejtben. Egy példa erre a fito-króm - fényérzékeny fehérjét szabályozó növényi fotoperiodikus reakció és opszin - része rodopszin pigment jelen a retina sejtekben.
Energy. A fehérjéket szolgálhat energiaforrás a sejt (hidrolízis után). Jellemzően fehérjéket fordított energiaszükségletének szélsőséges esetekben, amikor a kimerült tartalékok a szénhidrátok és zsírok.
Enzimek (enzimek). Ez a speciális fehérje, amely jelen van minden élő szervezetben, és úgy járnak, mint a biológiai katalizátorok.
Kémiai reakciók zajlanak az élő sejtben egy bizonyos hőmérsékleten, normál nyomáson és megfelelő savasságot. Ilyen körülmények között lenne anyagok szintézis vagy bomlási reakciók eljárni nagyon lassan a sejtben, ha azok nincsenek kitéve a enzimek. Enzimek A reakció meggyorsítása megváltoztatása nélkül a teljes eredményét a az aktiválási energia, azaz. E. Amennyiben jelen igényel lényegesen kevesebb energiát kölcsönöz molekulák reakcióképességének amelyek reagálnak, vagy a reakció a másik irányba alacsonyabb energiatartalmú akadályt.
Minden folyamat egy élő szervezetben közvetlenül vagy közvetve elvégzett részvételével enzimeket. Például, az intézkedés alapján alkotórészeinek élelmiszer-összetevők (fehérjék, szénhidrátok, lipidek és mások.) Hasítjuk, és egyszerűbb vegyületek, és belőlük ezután szintetizáljuk új jellemző az ilyen típusú makromolekulák. Ezért az oktatás és sérti az enzim aktivitását gyakran ad okot komoly betegségeket.
A térbeli szerveződés enzimek állnak több padló és a peptid láncok, és általában kvaterner szerkezetét. Ezen túlmenően, az enzimek közé tartoznak a nem-fehérje szerkezeteket. A fehérje részt hívjuk apoenzim és a nem-fehérje - kofaktor (ha a kationok vagy anionok a szervetlen anyagok, például, Zn2- Mn2 +, stb ...), vagy koenzim (CoA) (ha ez egy kis molekulatömegű szerves anyag).
Elődei vagy része sok Cofer-zsaruk vitaminok. Így, pantoténsav - komponenseként koenzim-A, niacin (PP-vitamin) - a prekurzor a NAD és NADP, stb ...
Enzimatikus azonos törvények alapján, mint a nem-enzimatikus katalízissel a vegyiparban, de ellentétben ez jellemzi a szokatlanul nagy fokú specificitás (csak az egyik enzim katalizálja a reakciót, vagy csak érvényes egy kapcsolat típusa). Ez biztosítja, hogy a finom szabályozása életfolyamatok (légzés, emésztés, a fotoszintézis és mtsai.) Kerül sor a sejt és a test. Például, ureáz enzim katalizálja a hasítását csak egy anyagot - karbamid (H2N-CO-NH2 + H2O -> - »2NH 3 + CO 2), anélkül, hogy gyakorolva katalitikus hatást szerkezetileg rokon vegyületek.
Ahhoz, hogy megértsük a hatásmechanizmus enzimek nagy specificitás, nagyon fontos elméletet az aktív centrum. Eszerint, a molekulában, valamennyi enzim egy vagy több részletben, amelyben a katalízis miatt előfordul, hogy egy közeli (sok pont) közötti érintkezési az enzim molekulák és a specifikus anyag (szubsztrát). Aktív hely vagy egy funkciós csoport cselekmények (például, az OH csoport a szerin), vagy egyes aminosavak. Általában, a katalitikus hatása van szükség, hogy több (átlagosan 3 és 12) elrendezve egy bizonyos sorrendben aminosavak. Az aktív centrum is keletkezik egy enzimmel kapcsolt fémionokkal, vitaminok és más vegyületek nem-fehérje jellegű - CO-enzimek vagy kofaktorok. Ezen túlmenően, az alakja és a kémiai szerkezete az aktív hely olyan, hogy képes kommunikálni csak bizonyos szubsztrátok miatt tökéletes (vagy komplementaritást. Kiegészítő jelleg) egymással. A szerepe más aminosav-maradékok a nagy molekula az enzim, hogy biztosítsa a megfelelő molekula globuláris formában, amely szükséges a hatékony működését az aktív centrum. Továbbá, körül egy nagy enzim molekula, egy erős elektromos mező. Ez a mező lehetővé válik orientációja a molekulák a szubsztrátum és a megszerzése aszimmetrikus formában. Ez vezet a gyengülését a kémiai kötések és a katalizált reakció lép fel, a kezdeti energiaráfordítás, és ezért sokkal nagyobb sebességgel. Például, a kataláz, egy molekula enzim lehet hasítva 1 percig több mint 5 Mill. Hidrogén-peroxid-molekulák (H202), amely akkor következik be oxidációja során különböző vegyületek a szervezetben.
Egyes enzimek jelenlétében egy szubsztrát konfiguráció az aktív centrum mértékben változik, t. E. Az enzim orientálja a funkcionális csoportokat úgy, hogy a legmagasabb katalitikus aktivitás.
A végső szakaszban a kémiai reakció az enzim-szubsztrát komplex felszabadul a kialakulását a végterméknek, és a szabad enzim. Üres egyidejűleg aktív központot elfogadhatja az új hordozó molekulához.
Az arány a enzimes reakciók sok tényezőtől függ .. A jellege és koncentrációja az enzim és a szubsztrát, hőmérséklet, nyomás, savasság a közeg, inhibitorok jelenléte, stb Például, közeli hőmérsékleten nulla, az arány a biokémiai reakciók lelassul a minimumra. Ez a tulajdonság széles körben használják a különböző gazdasági ágazatokban, különösen, de a mezőgazdaságban és az orvostudomány. Különösen, megőrzése különböző szervek (vese, szív, lép, máj) áthelyezés előtt a betegnek hűtés közben végbemegy, annak érdekében, hogy csökkentse az intenzitást a biokémiai reakciók és meghosszabbítja az élettartamát is testek. Gyors fagyasztási élelmiszeripari termékek megakadályozza a növekedését és szaporodását mikroorganizmusok (baktériumok, gombák, stb), Atakzhe emésztőenzimek inaktiválja őket úgy, hogy már nem képes okozni bomlása élelmiszerek.
Irodalom
NA Lemeza L.V.Kamlyuk ND Lisov „Biology kézikönyve Egyetem”