Kémiai alkoholátok katalógus
alkoholátok
Alkoholátok. szubsztitúciós termék a H-atomok az alkoholban molekulában, hogy a fém (M).
Alkogolyataodnoatomnyh alkoholok. Az M (OR) n. ahol az N-oxidációs foka a fém. Alkoholátjai lúgos, schel.-földet. fémek, T1 (1) és a primer alkohol-ionos vegyületek; infúzióban beadható, nem-illékony; . T különböző 200-300 ° C; oldható alkoholokban, és folyékony NH3; elektrolitok oldatban. Alkoholos oldatok jellemzően kicsapódnak, mint a kristály szolvátok. Származékok csoportjába tartozó fémek a III-VIII és alkoholok (kezdve C2 H5 OH) és az M 1 VAGY-mpem- molekuláris monomer vagy oligomer vegyület; alacsony olvadás- és forráspontja; Nagyon jól oldódik poláros oldószerekben, rossz-alkoholok; megoldások nem elektromos áram vezetésére. Metilálására ugyanazokat az elemeket, általában koordinációt. polimerek; infúzióban beadható, nem-illékony; nem szol. sem a oldószerek. A legtöbb alkoxid közepén a periódusos rendszer elemeinek tulajdonságait egyesítik ionos és molekuláris vegyületek (lásd. Táblázat.). Minden alkoholátok igen higroszkópos.
Jellemzése alkoxid [M (OH) n] m
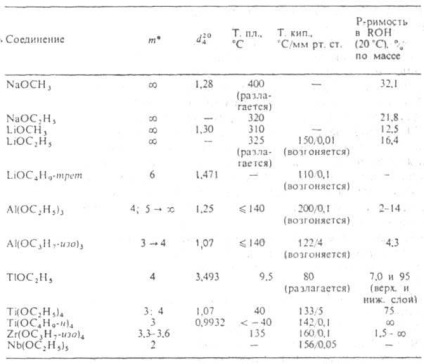
* M-asszociáció foka; nyíl mutatja a változás t öregedés.
C R nyúlás homológia. soraiban olvadáspontja, sűrűsége, törésmutatója, oldhatósága alkoholt általában csökken, és a forráspont hőmérséklete (szublimációs), H és S bepárlással, a viszkozitás növekszik. Terek. nehézségek növekszik az átmenetet a primer szekunder és R tercier akadályozza molekuláris Association. Az ugyanabban a sorban csökken forrási hőmérsékleten (lásd. Ábra. 1), a viszkozitás növekszik, és oldhatósága poláros oldószerekben. Sorozat alkoholátok többértékű fémek, mint például Al, Ga, Ti, Fe (III), sokaságát képezik társult különböző összetételű és szerkezetű (például, a VI általános képletű, és a IX). Az oligomer és polimer molekulák, melyek képesek a kölcsönös esztergálás, így a fizikai és kémiai tulajdonságai és reaktivitása az egyes hatóanyagok, alkoxidok változhat nagyon széles határok között (lásd. Ábra. 2).
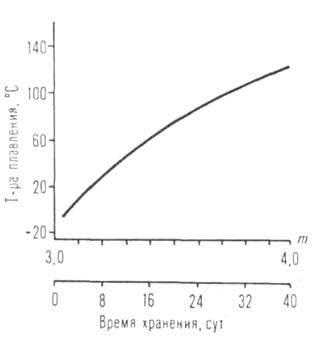
Ábra. I. reflux hőmérséklet-függését izomer -amiláttal Ti, Mb, Al, U leágazó R.
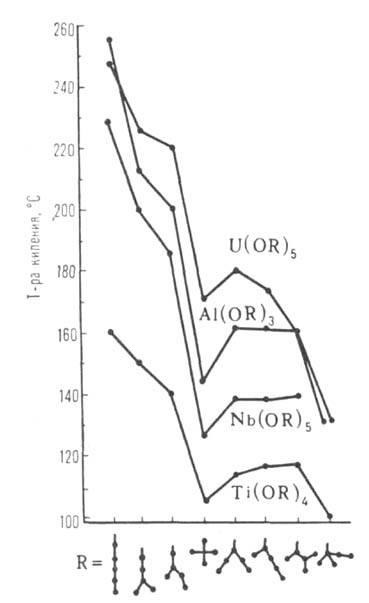
Ábra. 2. függése az olvadáspont [Al (OC-3 H7 -izo) s] t által az asszociáció foka (t) és a tárolási idő (az kristályosodni kezd).
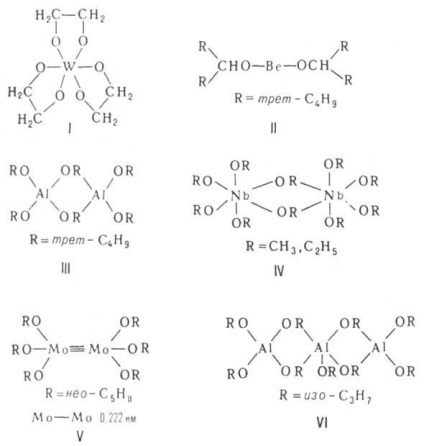
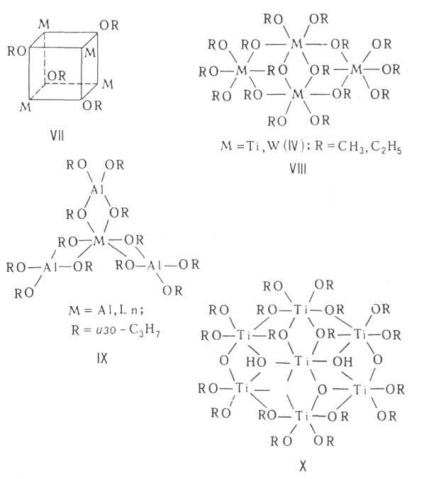
Szerkezet társult által meghatározott elv „min. Polimerizációs fok”, amelyben az összes atomok M eléréséhez stabil koordinációt. szám (miatt donor-akceptor közötti kölcsönhatás szabad pályák párok M és O atomok elektronok alkoxicsoportok szomszédos molekulák). Alkoxid monomer csak abban az esetben nagyon többfogú vagy elágazó láncú alkoxicsoport (lásd. Az I általános képletű, a II). Associates lehet a különböző struktúrák. A dimerek képesek kialakítunk egy szerkezetet, két poliéderek, például tetraéderek (III) vagy octahedrons (IV) egy közös él (OR) 2. Klaszterek Mo vagy W, tartalmazó többszörös kötések M-M (V). A molekulák jellemzően trimerek cyclol-lineáris láncú (VI), tetramerek kocka (TYUSN3. KOS4 H9 -t, CH3 ZnOCH3. VII), sík molekulák négy octahedra közös ig (VIII) vagy egy olyan molekula egy központi oktaéder és három tetraéderek a bordái (IX). Metoxid, etoxid és izopropoxid lúgos és schel.-földet. fémek alkotnak kristályos polimer. szerkezetét a rétegek a tetraéderek (például anti-PbO) és octahedra [típusú Ca (OH) 2], ill.
. Komplexálás alkoholokkal kíséretében megjelenése stabil kristály szolvátok [például LiOCH3 * 2CH3 OH, M számú különböző 28 ° C; . NaOC2 H5 * 2C2 H5 OH, t különböző 200 ° C; Ca (OC 2H 5) 2 * ns2 H5 OH, ahol n = 4 és 2, azaz. Magas és 60 100 ° C-on], jellemző elsősorban alkáli-alkoholátok és schel.-földet. fémek; abban az esetben, többértékű fémek szolvátok alkoholokkal és mások. Lewis-bázisok nem stabilak, akceptor funkció M teljesül képződése miatt a szilárd hidak vagy-társult a molekulák. Ismert szolvátjai [M (OC3 H7 -izo) 4 * L] 2. ahol M = Sn, Zr; L = = i-C 3H 7 OH, tetrahidrofuránban, piridinben, 2Ti (OR) 4 * En, 2AL (OC3 H7 -izo) 3 * En [En = (- CH 2 NH 2) 2], könnyen átmegy deszolvatálás. Azonban, Al [OCH (CF 3) 2] 3 * L [L = (C 2H 5) 2O, (C 2H 5) 3 N, (C 2H 5) 3 P] vákuumban desztilláljuk bomlás nélkül.
Amikor reagáltatjuk két különböző alkoxidok oldatban vagy az olvadék képződött bimetallich. A. (alkoksosoli Meerwein), amelyek jobban jellemző tulajdonságai molekuláris vegyület, mint a komponensek azokat alkotó. Például, Mg [Al (OC 2H 5) 4] 2 ellentétben polimer ethylates Mg és Al végtelenül a szerves oldószerekben oldható, desztilláljuk 195 ° C-on / 0,1 Hgmm (Olvadáspont: 181 ° C), dimert képez, nagyon stabil a gázfázisban és oldatban. Komplexálás fém-halogenidekkel alkoxid vezet alkoksogalogenidam -M (OR) n Halm. Anhidridek ásványi savak reagáltatva alkoholáttal só formájában alkilezett savak:
ahol EH2 = CO2. SO2. CS2; M = Na, Cu. Alkoxid típusú (izo-RO) 3 Mo = Mo (OR-izo) 3 reverzibilisen kötődik a CO, CO2 és visszafordíthatatlanul - O2. NO, C2 H2; kötésű ligandumok L (kivéve O2 és NO) áthidaltak:
Tartalmazó vegyületekkel aktív H-atom, alkoholátok lép kicserélődési reakció: M (OR) n + n HX -> MXN + n ROH, ahol X = Hal, OH, OR, SH, NH2, stb A reakciót széles körben használják a szintézis vízmentes. szervetlen és szerves származékai fémek, mint az egyetlen melléktermék ebben az esetben-alkohol.
A szabályozott hidrolízisen a fém-alkoxidok, multivalens nedvesség nyomait kristályosítjuk tartalmazó termékek oxo-hidak (lásd. Például X képlet). A végtermékek a hidrolízis alkoxidok - hidroxidok; tűnnek ki nagy reaktivitást, és stabil hidrogéleket dehidratált nagyon alacsony hőmérsékleten a kialakulását finom oxidok.
A okislit.-visszaállítás. választ, kíséri változás oxidációs állapota M, adja meg a fő átmenetifém-alkoholátok (a reakciót előállítására használt AA ugyanazon fémek az új oxidáció). Alkoholátokkal vagy alkáli schel.-földet. fémek elő, hogy egy fém-alkohollal. Alkalmanként ezt a reakciót egy szénhidrogén-oldószerben vagy folyékony NH3. Berillium, Al, Y, Ln reagál alkohollal jelenlétében HgCl2. I2. HHal vagy halogenidjei ugyanazon fémek. Alkoxidok Ge, Ti, Zr, Nb, Ta, Y, Sc és a La állítjuk elő anódos fém oxidációja alkoholban jelenlétében vezetőképes adalékanyagot [R4 N] Br. Alkoholátjai lúgos, schel.-földet. fémek, T1 (I), V (V), Mo (VI), Re (VII), Os (VIII) előállíthatók úgy is, alkoholízissel azok oxidok vagy hidroxidok:
Az egyensúlyi jobbra tolódik kötődés vagy a vizet eltávolítjuk desztillációval. Sokoldalú elég alkoxid szintézis módszert alkoholízis soros kapcsolás:
ahol X = H, R », NH2. NR 2. N [Si (CH 3) 3] 2 - azonban, a E módszer alkalmazása korlátozza nehézségek szintézissel MXN. A. szintetizáljuk alkoxilezési alkálifém-kloridok vagy alkoholátok NH3 elegyet ROH, jellemzően alkoholos vagy alkohol-benzol oldatban, például:
ahol M = Na, Li, NR4; n3. A szintézist az oldható alkoxid használt NaOR (NaCl kicsapott), a szintézis oldhatatlan, például metilatov, -LiOR (LiCl oldható CH3OH). A reakció képzése útján bimetallich. Alkoxid módszer módosítása - reagáltatásával könnyen hozzáférhető hlorometallatov piridinium sókat NH3.
ahol Py = piridin, M = Zr, Ce (IV), Pu (IV), UO 3+. UO2 2+. Equilibrium "átészterezés" alkoxid al-alkohol :. M (OR) n + n R »OHM (OR») n + n ROH jobb eltolásával ROH azeotrop desztillációval benzollal vagy ismételt bevezetése új ROH részek. Ha mindkét hőmérséklet közel forráspontú alkoholok megfelelő helyettesítő ROH-észter:
Vagy alkoxid átmenetifém sorozat állíthatjuk elő okislit.-visszaállítási. reakciók, mint például oxidáció Cr (OR-t) 3, az oxigén, bróm-vagy Pb (CH3COO) 4, Cr (OR-t) 4. Oxidálószerek észterek, például az U (OR) 5 alakítjuk át tevékenységüket a U (OR) 6. Recovery (NH4) 2 CrO4 egy alkoholos oldatban UV besugárzás vezet Cr (OR) 3; Ti (OR) 4 kinyerjük fémblokkba. K és a Ti (OR) 3. Alkoholátjai egyértékű alkoholok használják a szelektív redukciója a C = O (cm. Meervepna-Ponndorfa-Verley reakció Oppeiauera reakció), katalizátorként az diszproporcionálására aldehidek (lásd. Tishchenko reakció), a kondenzációs polimerizációs, és mások. A lúgos alkoholát-alkoxilezési szerek (lásd. Williamson-szintézis). Alkoholátjai Al és Ti-riasztószerek és térhálósító szerek és epoxi poliészter gyanták, szilikon polimerek. Termékek A részleges hidrolízis és pirolízis alkoxid poliorganometalloksany-komponens hőálló bevonatok. Miatt alkoholátok eredményeként a hidrolízis, továbbá pirolízis vagy oxidációja nagy tisztaságú kapunk, és az aktív fém-oxidok.
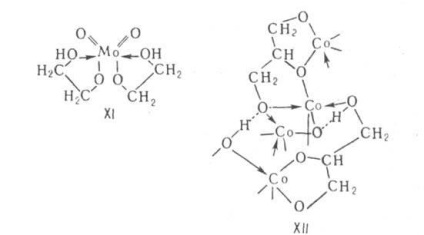
Alkoxidok glikolok és többértékű alkoholok. Naib. tanulmányozták alkoholátok glicerin (glicerát), és alkoholátok-glikol (glikolát). Alkoxidok többértékű alkoholok és glikolok -helaty (monomer, oligomer) vagy polimerek tartalmazó többfogú ligandumok. Fémlekötés fordulnak elő leggyakrabban között alkoxid nem teljesen esetben OH csoportok a kiindulási alkoholt (például, XI) általános képletű. Az ilyen alkoxidok hajlamosak szolvátokat képezhetnek bármely alkoholok. Ábrázoljuk higroszkópos kristályok; származékok és alkálifém schel.-földet. fémek oldódik alkoholokban elbomlanak 200 ° C alatti, mnogova- származékok. vegyértékű fémeket (Co, Ti, vagy hasonló.) sol. a nem-poláros oldószerek, illó és alacsony olvadáspontú. Teljesen szubsztituált alkoxid-amorf polimerek, kevésbé kristályos (például Co-glicerát XII) képletű vegyület. Ellentétben M (OAlk) n azok ellenáll a hidrolízisnek, oldhatatlan, olvasztható, hőálló.
Az egyszeresen helyettesített alkoholátok vannak kialakítva az intézkedés a többértékű alkoholok és diolok feleslegben alkálifém, schel.-földet. fém vagy MOAlk; teljesen helyettesített alkoholátok ugyanazon fémek, diszproporcionálódás magasabb hőmérsékleten:
2NaO (CH2) 2 OH NaO (CH2) 2 ONa + HO (CH2) 2 OH
Glikolátok diszubsztituált és triszubsztituált vegyértékű fém glicerát állítottuk elő kölcsönhatást oxidok, hidroxidok, M (OAlk) n. oxalátok, acetátok, sorrendben, egy glikol vagy glicerin-feletti hőmérsékleten 250 ° C-on
Egy adott osztály - piroforos termékek kölcsönhatása CO lúggal vagy schel.-földet. fémek (korábban gondolták „geksaoksibenzola sók”). Ők képviselik hipotetikus diszubsztituált származékok. acetilén Nosson.
Kémiai Lexikon. 1. kötet a cikkek listája >>