Gyorsító hatás (Joule-Thomson)
Gyorsító hatás volt megfigyelhető, és a Joule-Thomson ny jártas 1852 G. [Kísérletek azt találtuk, hogy megfojtja a munkaközeg hőmérséklet-változása. Ezt a jelenséget nevezik fojtás. A hőmérséklet megváltoztatása által fojtás annak a ténynek köszönhető, hogy minden igazi gáz, erők vonzás és taszítás között molekulák-CIÓ. Amikor táguló gáz fojtás előfordul kíséretében növekedése távolságban. Mindez azt eredményezi, hogy csökken a belső energia a munkaközeg, kapcsolódó költségek Rabo, hogy, viszont azt eredményezi, hogy a hőmérséklet változására.
Ideális gáz hőmérséklete következtében a fojtás nem változik Xia és fojtás ebben az esetben nulla. Így, a változás a valós gáz hőmérséklet, amikor fojtás határozza meg a tulajdonságait a valós gáz eltérés az ideális, mivel intermolekuláris erők.
Megkülönböztetése hőmérséklet-különbség és a szerves fojtószelep-hatásokat. A differenciális hatása a Joule-Thomson hőmérséklet-változások által egy végtelenül kicsi mennyiségű, és amikor az integrál - a véges-edik értékét. Ha a gáznyomás csökken infinitezimális voltak rang-DP, akkor van egy infinitezimális változás a hőmérséklet, azaz a dTi = ai dpi vagy
Az érték a ai nevezzük a hőmérsékletkülönbség fojtás. Az érték egy meghatározható egyenletből (lásd. § 5,48)
Tekintettel arra, hogy nincs fojtás entalpia változás (di = 0), félig cpm
A fojtószelep hatás lehet pozitív, negatív és egyenlő NYM nulla. Pozitív fojtószelep hatás lép fel az esetben, ha a droselirovanii gáz hőmérsékletet lecsökkentjük. Negatív - amikor Witzlaus. Ha a hőmérséklet invariancia amikor fojtás figyelhető meg, nulla fojtás. Feltétel igazi gáz fojtás, amikor a fojtószelep hatása nulla, az úgynevezett pont inverzió. Ezen a ponton van a hatása a hőmérséklet-változás a jel. Ha a gáz hőmérséklete alacsonyabb, mint az a hőmérséklet perod fojtás Inver ezeket, a gáz úgy lehűl fojtásával, ha több - ra melegítjük.
Annak érdekében, hogy megtalálják feltételeket, amelyek mellett van egy hőmérséklet-változás, vagy egy gázzal ry változatlan marad, akkor meg kell vizsgálni a egyenlet-a (7,19) van írva a formában
Gyorsító dp <0, так как давление газа всегда уменьшается. Теплоемкость ср - величина положительная. Отсюда следует, что знак dT
Attól függ, hogy a megjelölés és a kifejezés mindig is ellenezte azt.
T (dV / dT) p - v = 0 dT = 0. Egy esetben, ha dT = 0 lehet használni, hogy
megszerzése inverziós hőmérséklet THH.
A utóbbi kifejezés nevezik inverzió egyenlet görbe (a görbe, amelyen a fojtás hatás nulla).
Integrált fojtás határozza meg a szerves-rirovaniya egyenlet (7,20)
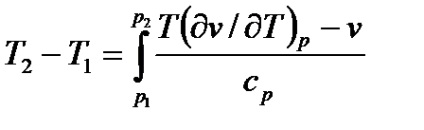
A technika elég gyakran kell foglalkozni a gáznemű vesche-stvami képviselő mechanikus keverékét, az egyes gázok, tulajdonságokkal közelít az ideális gázok.
Például, a légköri levegő tartalmazó gázkeveréket nitrogén-vezetőképes, oxigén, szén-dioxid, a vízgőz és számos más gázok. Op-paraméterek meghatározása szükséges megoldani sok gyakorlati problémákat.
Gázkeverék keveréke egyes gázok, kémiailag körte-al egymással, azaz egyes gázok a keveréket teljesen visszatartja az összes tulajdonságait, és elfoglalja a teljes keverék térfogatát. A nyomás, ami által létrehozott minden egyes molekula gázkeverékek, feltéve, hogy a gáz egy azonos mennyiségben azonos mennyiségű, és ugyanazon a hőmérsékleten, mint a keverék úgynevezett részleges (parciális) nyomása.
Feltesszük, hogy minden egyes gázkeverék kielégíti az egyenletet (2.7), azaz Ez egy ideális gáz. Ezért, a gázkeverék paramétereket is lehet kiszámítani Clapeyron egyenlet
ahol az összes mennyiségeket az egyenletben kapcsolódnak a gázkeverék.
Szerint a Dalton-törvény teljes nyomás ideális gázkeverék összegével egyenlő a gázok parciális nyomásának az elegyben
ahol p - nyomás alatt a keverékbe; egyes parciális nyomásértékeket a gázkeverék.
A gázkeverék lehet beállítani tömeg, térfogat és a mól frakciói.
Mass frakció - a tömeg aránya az egyes gázok össztömegére a keverék
Az összeg a részvények értéke egy
A térfogathányada - az arány a részleges (csökkentett) összege minden egyes második gázkeverék a teljes mennyiség
gáz; V - a hangerőt a gázkeverék.
A részleges térfogat - térfogatban, amely elfoglalható gáz, ha a nyomás és a hőmérséklet egyenlő a paraméterek egy gázkeverék.
A kötet frakció minden gáz állandó hőmérsékleten Boyle-törvény
Hozzátéve ezek az egyenletek Terminusonként azt találjuk, hogy az összeg a részleges OBE-mov azonos mennyiségű keverék (a törvény Amaga)
Ha összeadja térfogatarányából, megkapjuk
Boyle-törvény (állandó hőmérsékletű) nak pi / p-Vi / V itt
Az utolsó képlet lehetővé teszi, hogy meghatározzuk a compo-nents parciális nyomása az elegyet, ha ismeretes, ömlesztett készítmény.
Beállítása elegyet moláris arányát a következő. Először is, azt látjuk, az anyajegyek száma az egyes komponensek szerinti keverék a kapcsolatok
ahol M1. M2. .... Mn - móljainak száma minden egyes komponens; μ1. μ2, ..., μn-mo-megfelelő molekulatömegű komponensek keveréke.
Ezért minden gázkeverék tartalmaz M mól
Mole frakciókat yi (i = 1,2,3, ..., n) olyan kapcsolatban vannak,
Mivel M = m / μ, μ a molekulatömege a keverék fogja meghatározni a következő képlettel
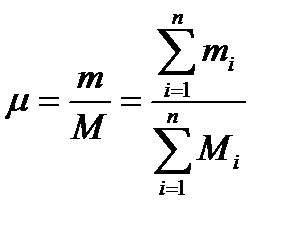
A kapott érték az úgynevezett látszólagos átlagos értéke Molec-ular a keverék tömegének. Ismerete a molekulatömeg lehetővé teszi az (2.9a) R = 8,3143 / μ lokalizálják R gázállandó a keverék (következő képlet, hogy meghatározzák az ismert μ R látható).
A törvény Avogadro moláris mennyiségű különböző gázok azonos nyomás és hőmérséklet azonos (azonos térfogatú gázok, tartalmaznak zhitsya azonos számú molekula). Ennélfogva, az i-edik gázkeverék aránya spraved-Livo
ahol Vμ - által elfoglalt térfogat egy mól gáz.
Ahhoz, hogy a teljes keverék
Következésképpen, a moláris frakciót és térfogat számszerűen egyenlő.
Mi származhat képlet molekulatömegének meghatározására a keverék annak Ob-emnomu készítmény. A fentiekből az i-edik komponense lehet írni
vagy a teljes keverék
Cseréje az utolsó egyenletben a molekulatömege sűrűsége (az Avogadro-törvény), megkapjuk
Abban az esetben, ha a gázkeverék kapott készítmény tömegére, a állapotegyenlet
Ahhoz, hogy a nyomás a teljes keveréket képletű
Tekintettel arra, hogy pV = MRT, hogy
A ismert gázállandó keveréket a következő képlet segítségével (2.9a), de megtalálható a molekulatömege a keverék.