Ülepítés és diffúziós egyensúly (hipszometrikus jog)
A szolokat keresztül egy bizonyos, néha nagyon hosszú idő, a beállási idő a részecskék fordulhat elő, ha a diffúziós fluxus egyenlővé válik szedimentációs idif = ised. azaz jöjjön diffúzió sedtsmentatsionnoe egyensúlyt. Mivel ezt az egyensúlyt akkor jelentkezik, amikor egy bizonyos koncentráció gradiens, a rendszernek meg kell telepíteni a megfelelő elosztását a diszpergált fázis beállítás. Jog meghatározására ezen eloszlás, akkor használja ezt a kapcsolatot (idif = ised), figyelembe véve, hogy
és cseréje az x h (magassága hossza):
Az elválasztás után a változók kapjuk:
Integrálása között ν0 hogy νh és ennek megfelelően 0 és h = h, azt találjuk:
Ez az egyenlet az úgynevezett hipszometrikus törvény (a latin hypsos -. Magasság).
Ha összehasonlítjuk az ülepedés jelenlétében diffúzió és nélküle, említésre méltó különbség a tényezők, amelyek biztosítják a stabilitást szétszórt rendszerek a csapadék - ülepítés stabilitását. Ezek a tényezők teszik lehetővé a különbségtételt a kinetikus ülepítés stabilitás (SIC), és a termodinamikai stabilitása ülepítés (TAS).
Az intézkedés a kinetikus ülepedés stabilitás a kölcsönös a folyamatos ülepítő:
TAS intézkedés a hipszometrikus magasságot. Sokkal kényelmesebb, hogy meghatározza, hogyan magasságát. , amelyek koncentrációját a diszpergált fázis megváltozik e.
Ez a képlet azt mutatja, hogy a magasság és a rendre hipszometrikus termodinamikai ülepedési stabilitása nagyobb, minél kisebb a részecskeméret, és a sűrűség közötti különbséget a részecskék és a közeg. A viszkozitás nem befolyásolja a TAS, míg (a ugyanakkor hozzájárul a hőmérséklet növelésével a stabilitás, mivel a fokozott hővezető mozgást. A kinetikai ülepedési stabilitása a hőmérséklet növelésével általában csökken, mivel a redukált viszkozitása a közeg.
Elektroforézis bentonit agyag diszperzió lép fel az alábbi körülmények között: az elektródák közötti távolság 25 cm, 100 V, 15 perc részecskék mozdult 11 mm az anód felé. Számítsuk ζ-potenciál, tekintettel arra, hogy ε = 78,2, és η = 9,9 · 10-4Pa · sec.

Vizsgálat jegy № 8
Besorolás adszorpciós mechanizmusokat. Természet adszorpciós erők és azok jellemzőit fizikai adszorpció. Származtatása az egyenlet az energia diszperzív kölcsönhatását az atom az adszorbenssel adszorbátum. Izoterma izoszter isopycn adszorpció.
Adszorpciós folyamatok szerint osztályozzák a típusú kölcsönhatás az adszorbeátum az adszorbensről. Fizikokémiai osztályozás alapja az a feltevést, hogy a újraelosztása a komponensek közötti ömlesztett fázis és a felületi réteg kerülhet sor hatása alatt fizikai erők sem a kémiai reakció között az adszorbeátum és az adszorbens. A kémiai reakció ebben az esetben is képviseli, mint akár egy kémiai kapcsolódási atomok (molekulák), vagy mint egy ioncserélő kölcsönhatást. Így szerint a fiziko-kémiai osztályozási megkülönböztetni fizikai (molekuláris) adszorpció, kemiszorpció (kémiai kapcsolása atomok, molekulák) és az ioncsere.
A fizikai adszorpció közötti kölcsönhatás adszorbens és adszorbeátum segítségével végzik, van der Waals-erők és hidrogénkötések. Ezek az erők biztosítják adszorptív vonzás atomok (molekulák); nagyon közel áll a rövid hatótávolságú taszító erők jelennek meg.
A kémiai adszorpció egy kémiai kötés között van kialakítva az adszorbeátum és az adszorbens, és elvesztik egyéniségüket.
A kis molekulák dipólusmomentumának fő hozzájárulása a kölcsönhatási energia diszperzív erők hozzájárulnak. Fontos, hogy mind a három összetevője a Van der Waals erő az egy és ugyanazon törvény változása az energia vonzás távolságból :.
Mivel a teljes energia a interakció, amikor az adszorpciós mennyisége határozza Uads kölcsönhatási energia adszorbeált atomok valamennyi atom a térfogatban az adszorbens, majd
A mennyiség dV lehet meghatározni a felszínen a gömbszelet:
Mi integrálja távolságon belül legfeljebb r = x r = ∞, és végül megszerezni:
A függését adszorpciós értékek a koncentráció (vagy parciális nyomás) egy anyag állandó hőmérsékleten nevezzük adszorpciós izoterma.
A függését adszorpciós PRV hőmérséklet állandó koncentrációjú (vagy parciális nyomás) nevű anyag isopycnals (vagy izobár) adszorpciós.
A függőség a koncentráció (vagy parciális nyomás) anyagok mennyiségének a hőmérséklet állandó értéken úgynevezett adszorpciós izoszter adszorpciós.
Kétféle stabilitását diszperz rendszerek. Lipofil és liofil rendszert. Criterion lipofil és liofil által Rebinder-Shchukin. Termodinamikai és kinetikai tényezők stabilitását diszpergált rendszerek.
A javaslatot a N. Peskov stabilitását diszperz rendszerek két típusa van: ellenállás a lerakódás a diszpergált fázis és az ellenállás a aggregáció annak részecskék. Az első típusú stabilitást jellemzi azt, hogy a diszpergált rendszer fenntartása egyenletes eloszlását a diszpergált fázis részecskéihez térfogat és a diszperziós közeg, vagy annak ellenállását fázisszétválás - szedimentációs stabilitás. A második forma stabilitási - aggregációs stabilitás (blokkoló ellenállás) diszperz rendszereket.
Minden diszperziók szerinti eljárással azok kialakulásának mechanizmusa besorolása P. Rebinder osztva liofil, amelyeket úgy kapunk, spontán diszperzióját egy fázis (heterogén svobodnodispersnoy spontán képződését rendszer), és liofil, a kapott diszperzió túltelítettség és kondenzáció (kényszerített oktatási svobodnodnspersnoy heterogén rendszerben).
Különbséget tenni termodinamikai és kinetikai tényezők agregatnvnoy stabilitását diszperz rendszerek. Mivel a hajtóerő a túlzott véralvadás felületi energia, a fő tényező, amely a stabilitás biztosítása érdekében a diszperz rendszerek (miközben a méret a felület), majd azok, amelyek csökkentik a felületi feszültséget. Ezek a tényezők kapcsolódnak a termodinamikai. Ezek csökkentik a valószínűsége hatékony ütközések részecskék közötti, ami a potenciális akadályokat, amelyek lassítják, vagy akár kivéve az alvadási folyamatot.
Kinetikai tényező, amely csökkenti a koagulációs sebességet, főleg kapcsolódó hidrodinamikai tulajdonságait a közeg: egy lassulási konvergencia szemcsés szivárgást és megsemmisítése a közeg rétegek közéjük.
Vannak a következő termodinamikai és kinetikai stabilitását diszperz rendszerek tényezők:
1. Elektrosztatikus tényező, hogy csökkentse a felületi feszültség miatt az esemény a villamos kettős réteg a részecske felületén a következő egyenlet szerint Lippmann.
2. Adszorpciós-szolvatációs faktor az, hogy csökkentik a feszültséget a kölcsönhatás a diszpergált fázis részecskéi a közeggel (miatt adszorpciós és szolvatációs)
3. entrópia tényező, mint az első kettő, és azokra a termodinamikai. Ez kiegészíti az első két tényező, és működik a rendszerek, amelyekben a részecskék vagy felületi rétegek részt vesznek a termikus mozgás.
4. Strukturális és mechanikai tényező kinetikus. Hatása annak a ténynek köszönhető, hogy a felületi részecskék film, amelynek rugalmasságát és mechanikai szilárdság, amelynek kudarca időt igényel, és az energiaköltségeket.
5. hidrodinamikai tényező csökkenti koagulációs sebesség változása miatt a közeg viszkozitása, és a sűrűsége a diszpergált fázis és a diszperziós közeg.
6. A zavaró tényezők leginkább jellemző valós rendszerekben. Jellemzően aggregatív biztosított stabilitás több tényező egyidejű.
Az az állapot termodinamikai stabilitása agregatnvnoy diszperz rendszer felírható:
Ez azt jelenti, hogy a Gibbs energia nem növelheti a felület (állandó határfelületi feszültséget), vagy csökkenő részecskeméret. A határfelület spontán nőnek, ha a felületi energia ellensúlyozzák majd növekedése entrópia a rendszer. Ezt a jelenséget nevezzük spontán diszpergál.
E rendelkezések legyen spontán diszperziós egyenlet Rebinder-Shchukin:
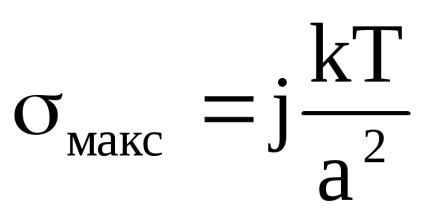
Használata hipszometrikus jog kiszámításához szol Al2O3vysotu, amellyel a részecske koncentrációt faktorral csökken e. Fogadd el, hogy gömbalakú részecskék formájában, a fajlagos felülete a diszpergált fázis 3 x 103m-1, Al2O34000 sűrűsége kg / m3, a sűrűsége a diszpergáló közeg 1000 kg / m3, 20 ° C-on
