Ellenőrizze 3 320405 11 feladatok megvalósítási módja
Ellenőrizze 3 320405 11 feladatok megvalósítási módja
külön a fájlban: 3203
Mi elektronegativitási? Hogyan működik a elektronegativitási p - abban az időszakban elemek a periódusos rendszerben csoport egyre atomi száma? Miért?
elektronegativitási
Elektronegativitás (EO) atomot a molekulában képesség (vegyület) vonzza az elektronokat összekötő más atomok.
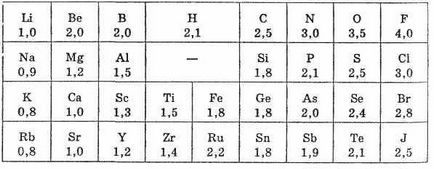
A koncepció a elektronegativitási be Pauling (USA, 1932). Kvantitatív jellemzésére elektronegativitási az atom nagyon feltételes, és nem lehet kifejezni a fizikai mennyiségek, ezért a mennyiségi meghatározására EO felajánlott több mérleget. A legnagyobb elismerés és forgalmazása skálán kapott relatív EO által kifejlesztett L. Pauling (lásd. Táblázat. 1.).
Egy skálán Pauling EO fluort (a legtöbb elektronegatív összes elem) hagyományosan feltételezzük, hogy 4,0; a második helyen van az oxigén, a harmadik - a nitrogén és a klór. Hidrogén és tipikusan nem-fémek közepén a skála; érték közel van a EO 2.
A legtöbb fém van egy EO-értéke közelítőleg egyenlő 1,7 vagy kisebb. Megjegyezzük, hogy az EA dimenzió.
1. táblázat értékei elemek elektronegativitási szerinti Pauling
Az arány közötti elektronegativitási különbség, és a foka iontartalma kötés

Nem nehéz felfedezni egy érdekes mintát - a skála Pauling általában hasonlít a periódusos rendszer elemei. Ez a skála lehetővé teszi, hogy megítélje az ionizációs (polaritás) kapcsolat. Erre a célra a függőség a különbség az EA és a mértéke iontartalma kapcsolat (táblázat. 2).
Táblázat. 2, hogy minél nagyobb az EO, annál nagyobb mértékű a iontartalma. A különbség EO egyenlő, mint 1,7, 50% -ának megfelelő - Nome ionos jellege kötéseket, de mivel a különbség EO mint 1,7 tekinthető ionos. Mivel a különbség kisebb utal, hogy a kovalens poláris.
Ahhoz, hogy mennyiségileg a jellemzői javasolt intézkedés a elektronegativitása energia egyenlő a számtani összege a ionizációs energia (D) és elektron-affinitása (E), R. F.
ahol X - atom elektronegativitása, és így az elem.
Példaként, definiáljuk X fluoratomot és lítium. A megjelenés-up asztalok azt találjuk, hogy IF = 17,42 eV, EF = 3,62 eV, ILi = 5,39 eV, ELi = 0,22 eV (számított közvetve).
Ezután XF = 17,42 + 21,04 = 3,62 eV és XLI = 5.39 + 0,22 = 5,61 eV.
A fluor a legnagyobb érték az I + E, ezért a legtöbb elektronegatív elem. A legkisebb értéke elektronegativitási alkálifém atom.
Jellegzetesen lítiumot elektronegativitási fogadó egységet és az azt hasonlítja össze más elemekkel elektronegativitása. Majd kap egyszerű és könnyű összehasonlítani a relatív értéke a elektronegativitási elemek (fogjuk jelöljük x):
XLI = 1; xF = 21,04 / 5,61 »m és 4. d.
Jelenleg elterjedt asztal relatív electronegativities előállításában, amelyek használják a legújabb adatok elektronikus atomok és a sugarak.
Meg kell jegyezni, hogy mivel a különböző könyveket kémiai értékek relatív electronegativities eltérnek kissé. Ez annak köszönhető, hogy az a tény, hogy azokat más módszerekkel számolva alapuló bizonyos feltételezések és találgatások.
K p - egység 30 elemek IIIA-VIIIA a periódusos rendszer, és magában foglalja a második és a harmadik a kis ideig, és a negyedik - hatodik időszakok hosszú.
A csoport elemeit IIIA az első elektron jelenik meg o - pályák. A többi csoportban IVA-VIIIA szekvenciálisan feltöltésnél p - szintalatti 6 elektronok. A szerkezet a külső elektronikus héját atomjai elemek p - ns2npa blokkolja. ahol a = 1 ÷ 6.
Időszakokban elhagyta, atomi és ionos sugarak R - elemek növekvő felelős a mag csökken, az ionizációs energia és elektron-affinitása a általános növekedése, elektrootritsatelnostuvelichivaetsya. oxidációs aktivitását egyszerű anyagok és fémes tulajdonságok fokozott.
A kifejezés elektronegativitási növekedésével nő atomszáma az elem (balról jobbra), míg a csoportban. általában csökken a növekvő költség mag (felülről lefelé).
Szigorúan véve, az elem nem tulajdonítható, hogy az állandó elektronegativitási. Elektronegativitás atom számos tényezőtől függ, különösen a vegyérték állapotban az atom, a formális oxidációs állapota a koordinációs számát, a természet a ligandum alkotó környezetet az atom egy molekuláris rendszer, és mások.
Az utóbbi években egyre inkább, hogy jellemezzük az elektronegativitási segítségével az úgynevezett orbitális elektronegativitása, attól függően, hogy milyen típusú atomi pályák kialakításában játszik szerepet a kötések, és annak az e-populációban, azaz. Az E. On elfoglalt atomi pályák osztatlan elektronpár, egyszer lakta párosítatlan elektron vagy betöltetlen.
De annak ellenére, hogy az ismert nehézségek értelmezése és meghatározása eiektronegativitás mindig szükséges minőségi leírást és előrejelzése a természet kapcsolatok a molekuláris rendszer, beleértve a kötési energiája az elektron töltése eloszlását és iontartalma, az erő állandó, és így tovább. D.
Így, a legkisebb érték az elektronegativitása az elemek s-1-csoport, és a legnagyobb p-tagok a 6. és 7. csoport.
feladat №23
Számítsuk ki a reakció-hő csökkentésének vas-oxid (II) hidrogénatom. alapján az alábbi termodinamikai egyenletek:
FeO (a) + CO (g) = Fe (a) + CO2 (g) # 916; H = -13,18 kJ
CO (g) + 1/2 O2 = CO2 (g) # 916; H = -283,0 kJ
H2 (g) + 1 / 2O2 = H2O (g) # 916; H = -241,83 kJ
1. A termikus hatása a különbség összegek reaktsiiraven melegíti képződésének termékek és reagensek figyelembe véve a sztöchiometrikus együtthatók egyenletben állva.
Hő obrazovaniyalyubogo nevű anyag termikus hatása reakciók képező 1 mól vegyület egyszerű, t. K. abszolút értéke az entalpia nem mérhető, a termokémiája egyszerű anyagok hagyományosan hőtermelés van állítva 0.
Minden hőhatás lehet hasonlítani egymással összes anyagot hozott a standard állapotban (kiválasztva).
Gáz - egy állami P = 105Pa
A szilárdtest - a legtöbb állandósult krisztallográfiás módosítását. (C - grafit gyémánt.).
Folyékony - C = koncentráció 1 mol / l
A égéshőjének anyagok kialakulását tartalmazott kézikönyvekben.
Reakció egyenlet állapotát meghatározó aggregáció vagy kristálymódosulat körül karakterek kémiai vegyületek, valamint az érték a hőhatás nevezzük termokémiai.
Annak érdekében, hogy kiszámítsák a reakcióhő csökkentésének vas-oxid (II) hidrogénatom,
Mi használjuk a következménye a törvény Hess és hőhatás reakciók adott azáltal, hogy a képződéshő egyszerű anyagok 0.
a reakció
H2 (g) + 1 / 2O2 = H2O (g) # 916; H = -241,83 kJ
a reakció
Feladat № 63
A reakció a következő egyenlet szerint N2 + O2 = 2NO. A koncentrációk a kiindulási anyagok, mielőtt a reakciót a következők voltak: [N2] = 0,049 mol / l; [O2] = 0,01 mol / l. koncentrációjának kiszámításához ezeknek az anyagoknak a pillanatban. ahol [NO] = 0,005 mol / L.
A függőség a kémiai reakció sebessége a reagensek koncentrációja határozza meg a tömeghatás törvénye (ZDM).
Szerint ZDM reakciósebesség áramló egyetlen lépésben, állandó hőmérsékleten arányos a termék moláris koncentrációja a reaktánsok fokban, egyenlő a sztöchiometriai arányok.
Következésképpen, a reakcióhoz
előre reakció sebessége
ahol v - sebessége reakció
k arányossági tényező, hogy az úgynevezett állandó reakció
C (N2) és c (O2) - moláris koncentrációja a nitrogén és az oxigén
Az arány a fordított reakció
Kiszámításához a koncentráció a reaktánsok egy táblázatot, az egyértelműség és a kényelem a számítások
Feladat száma 000
Hogy az elektronikus egyenletet és meghatározza, hogy milyen folyamat - az oxidáció vagy redukció -proiskhodit a következő reakciók:
As3-®As5 + ® N3 + ®N3- S2-®S0
Egyenletek alapján elektronikus gondoskodik az együtthatókat a reakcióegyenlet kiterjesztése a rendszer:
Úgynevezett redox reakció kíséri változás az oxidáció mértékét az atomok szereplő reagensek.
Az oxidációs állapot (p) megvalósítani a kondicionált felelős az atom, amelynek kiszámítása a feltételezéssel, hogy a molekula az csak ionok. Más szavakkal: az oxidáció mértékét - a feltételes töltéssel, amit akkor szerzett atomja, feltételezve, hogy nem kapta meg, és küld egy bizonyos számú elektronokat.
Redox - egy egységes, összefüggő folyamat. Oxidációs növekedéséhez vezet az oxidációs foka a redukálószer, és a helyreállítási - annak csökkenése az oxidálószer.
Emelésével vagy csökkentésével a oxidációs foka atom a visszavert elektron egyenletek: oxidálószer elektronokat, és a redukálószer ad nekik.
Nem számít, hogy az elektronok mozogni az egyik atom egy másik teljesen kialakult és az elektronikus kommunikáció, vagy csak elektronokat húzott egy elektronegatívabb atom keletkezik poláris kötés.
A képessége egy anyag mutatnak oxidációval, redukcióval vagy kettős (mint például oxidáció és redukció), a tulajdonságok lehet megítélni az oxidáció mértékét az oxidálószer és a redukáiószer atomok.
Atom egy elem a legmagasabb oxidációs állapotban nem tudja megnövelni (elektrondonor), és mutat csak oxidáló tulajdonságai. és annak legkisebb oxidációs állapot nem engedje le (fogadja elektron), és mutat csak vosstanovitelnyesvoystva. Atom az azonos elem, amelynek közbenső oxidációs állapotban van. Ez egyaránt lehet oxidáló és redukáló tulajdonsága.
1: Írjon egy e-egyenletet és jelzi, hogy milyen folyamat - oxidáció vagy redukció - akkor jelentkezik, amikor a következő reakciók:
oxidációs folyamat. ahol As3- arzén atom oxidációs állapotban 3 (kisebb oxidációs állapotába, hogy az arzén) egy redukálószer.
A helyreállítási folyamat. ahol N3 nitrogénatom oxidációs állapotban + 3 (köztes oxidációs állapotban a nitrogén) egy oxidálószer.
oxidációs folyamat. S2-, ahol a kénatom oxidációs állapotú -2 (alacsonyabb oxidációs állapotban ként) egy redukálószer.
2. alapján egyenletek elektronikus elválás együtthatókat a reakcióegyenlet kiterjesztése a rendszer:
S + 4 = S + 2e || 6 3 - redukáiószer
Mn + 7 + 3e = Mn + 4 || 2 - oxidálószer
Tekintettel az elektronikus egyenletek és a törvény tömegmegmaradás, hogy helyezze a koefficiensek egyenlet
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Feladat száma 000
Amikor koncentrációban Zn2 + (mol / l), a potenciális a cink elektród kisebb lesz, mint 0,015V annak standardpotenciál?
Ha plakk vízbe mártottuk, a fém kationok felületén a hidratált poláros vízmolekulák és át a folyadékot. Az elektronok feleslegben maradó felületi fémréteg a töltés negatívan. Egy közötti elektrosztatikus vonzás a folyadék esett a hidratált kationok és a fém felületén. Ennek eredményeként a dinamikus egyensúlyi állapot jön létre a rendszerben:
oldatban a fém
ahol n - az elektronok száma a folyamatban részt vevő.
A fém - folyadék keletkezik egy elektromos kettős réteg jellemzi egy bizonyos ugrás kapacitás - elektróda potenciálja.
Az abszolút értékek elektród potenciál nem mérhető.
Elektróda potenciálok több tényezőtől függ (a fém fajtájától, koncentráció, hőmérséklet, stb). Ezért általában meghatározza a relatív elektród potenciál bizonyos feltételek mellett - az úgynevezett standardpotenciál (E0).
A standardpotenciál a fém az úgynevezett annak elektród potenciál által kifejlesztett merítjük a fém oldatban saját ionok koncentrációjának (avagy aktivitásától) 1 mol / dm3, mérve, összehasonlítva egy standard hidrogén elektród, a potenciális, amely 250 ° C hőmérsékleten szokásosan venni nulla (E0 = 0 ; # 916; G0 = 0).
Fémekkel száma egyre azok standardpotenciál (E0), megkapjuk az úgynevezett stressz tartományban.
A helyzetét a fém az elektrokémiai sorban jellemzi annak rugalmasságát és oxidatív tulajdonságai ionok vizes oldatok standard körülmények között.
Minél kisebb az értéke E0, a nagyobb ellenálló képesség területén aktív fém, mint egy egyszerű anyag és a kisebb oxidativ kapacitása mutatnak annak ionok, és fordítva.
Elektródpotenciálok mértünk az eszközöket, amelyek az úgynevezett galvánelemek.
A redox reakció, amely jellemzi az a cella működése irányában áramlik, ahol az elektromotoros erőt cellában van egy pozitív érték. Ebben az esetben, # 916; G0 <0, так как
Az elektróda potenciálja a fém (E) attól függ, hogy koncentrációja az ionokra oldatban. Ez a függőség fejezi ki a Nernst egyenletet:
ahol - a standardpotenciál;
n - az elektronok száma a folyamatban részt vevő;
- Sűrűség (pontos számítások - Activity) hidratált fémion oldatban, mol / dm3;
Határozza meg, hogy milyen koncentrációjú Zn2 + (mol / l), a potenciális a cink elektród kisebb lesz, mint 0,015V annak standardpotenciál felhasználás, amelyre a Nernst-egyenlet:
0,059 * lg [Zn2 +] / n = E (Zn2 + / Zn) - E0 (Zn2 + / Zn)
lg [Zn2 +] = 0,015 * 2 / 0,5 = 0,059
Feladat száma 000
CuSO4 oldatot az elektrolízis során az anód különítettek 168 cm3 (n. Y.) gáz. Hogy az elektronikus egyenlete lezajló folyamatok az elektródok, és kiszámítja, hogy mit állt ki a tömeget a réz katód.