A készítmény az atommagok
lecke témában - „A kompozíció a atommagok izotópok.”. Megismételjük, milyen elemi atom modell, szerkezete hasonló a mi Naprendszerünk. Megtudjuk, mit évben fizikusok megtanulták a tapasztalat Rutherford, ahonnan tevődik össze a sejtmag, a sűrűség, hogyan juthat egy új elemet, hozzáadva a proton.
Tárgy: periodikus törvény és a periódusos D. I.Mendeleeva
1. Szerkezet A Atom
Elementary atom ténylegesen kiderült, hogy egy komplex részecske, amely egy mag, és az elektron héj. Szerint a szerkezet hasonlít a Naprendszerben. Naprendszerünk található a tömegközéppontja a nap, és az atom - a sejtmagba. Úgy forog a Nap körül bolygó, atom - az elektronok. Ez a modell az atom létrehozott 1910-ben Ernest Rutherford. Csak 1932-ben, fizikusok felfedezték, hogy az atommag alkotja az elemi részecskék: protonok - pozitív töltésű és díjmentesen - a neutronok.
Atom kitalálásával Rutherford majdnem üres tér van a mag a közepén. Core - nagyon sűrű az oktatás, amely a protonok és a neutronok. atommag sűrűsége eléri a 100 000 tonna / mm3. Hozzáadása egy proton a atommag, minden alkalommal, amikor egy új elemet kapunk. Ha a nucleus 1 proton H pedig hidrogén, ha 2 - ez nem hélium, ha ez a 3- lítium Li. És így tovább.
Azt mondják, hogy a protonok ad egy atom egyediségét. De neutronok nem befolyásolja az egyes atomok, de vannak rögzítve csak a súlya a tételt.
2. nuklidok
Nuklidok - van egy részecske, amelynek fajlagos tömege száma és az idő az élet elegendő a tanulmány. Nuklidok vannak osztva
- stabil. Stabil nuklidok nem mennek keresztül spontán radioaktív bomlás.
- radioaktív vagy radionuklidok. A radionuklidok spontán jutnak alkotnak más nuklidok.
Radionuklidok vannak osztva
Hosszú felezési idejű radionuklidok merült fel a Földet. Felezési idejük 5 ∙ 108let.
A legnagyobb mennyiségű radionuklid 34 platina Pt és ozmium Os. Vannak olyan tételek, csak egy stabil nuklid. Például, arany Au és kobalt Co. A maximális számú stabil nuklid 10 rendelkezik ón Sn. Sok eleme minden nuklidok - radioaktív. Ezek mind olyan elemek, amelyek ös nagyobb, mint az ólom Pb és technécium Tc prométium Pm. A teljes száma minden nuklidok összes elem meghaladja 3100.
3. A koncepció az izotópok
a neutronok száma a atommag nevezzük annak izotópos számát és jelöljük N.
Ha egy atom tartalmazza a protonok száma megegyezik. t. e. ugyanaz a díj, de különböző számú neutront. akkor azt egy másik tömeg. Az ilyen atomok nevezzük izotópok.
N - száma izotópos
A - tömegszám
Z - töltésszám
Amikor hivatkozva számos izotópjainak egy kémiai elem a szimbólumot a bal felső sarkában a tömegszám van írva, és a bal alján - töltés száma. 612c. Néha talál a következő bejegyzést: szén -12.
Egyes izotópok saját nevét. Ez jellemző a hidrogén és a radont. hidrogén izotóp 1H - Protium, 2H - deutérium, 3H - trícium.
Arra is lehetőség van, hogy megfeleljen az oxigén izotópok 16O, 17O, 18O, ami a természetben megtalálható.
A relatív atomtömeg elem

Ábra. 1. klór izotópok
Egy atom nagyon kicsi, tömege elhanyagolható. 1961-ben, az International Congress Elméleti és Alkalmazott Kémia, fizika és vegyészek úgy döntött, hogy a tömeg az atom kell mérni nem kilogrammban vagy grammban, és egységekben, ismert, mint a atomi tömegegység (a. EM). Azt feltételezték, hogy a szén-dioxid-izotóp -12, a legstabilabb a természetben lesz tömege 12. EM A atomtömeg egység egyenlő nagyságú:
1 mól bármely anyag részecskéket tartalmaz egyenlő Avogadro számát.
4. klór izotópok
Relatív atomtömeg elemet, amely tartalmazza a periódusos rendszerben - az átlagos értéke a tömegszáma a természetes izotópok alapján százalékos a természetben.
Például, az összes atom a természetben klór- izotópok 35CI (75%) és 37 Cl (25%). 1. ábra.
A relatív klór atomsúlya kiszámítása a képlet = 35,5.
5. hidrogén izotópok
Hidrogénatom, proton a sejtmagban, és amelynek egy neutron nevű Protium. "Protasov," - az elsődleges. Az úgynevezett első izotóp hidrogén.
Ábra. 2. Hidrogén izotóp deutérium
Ha hidrogénatom egy proton mellett is tartalmazza egy neutron. hogy fogják hívni a deutérium.
Deutériumgázt például a hidrogén, a kétatomos molekula D2.
Ez a gáz a légkörben nagyon kicsi, csak 0,012 a teljes tömegének hidrogéngáz. A deutérium része nehézvíz. A formula D2O. A fizikai tulajdonságai eltérnek a fizikai tulajdonságait normál víz. Tab.1.
Összehasonlítása a fizikai tulajdonságait a nehézvíz közönséges.
6. A háború nehézvíz

Ábra. 3. Növényi a nehézvíz előállítására Norvégia
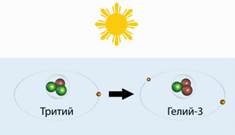
A készítmény tartalmaz 2 trícium neutron és proton-1. Betűvel jelöljük T .. A trícium - egy rövid életű izotóp a hidrogén. Úgy született a felső légkörben okozta kozmikus sugárzás.
Született, hogy meghaljon, ott és akkor - hogy egy hélium-3.
Ő csupán 6 gramm egész légkör. 1 trícium atom számlák 10 cm3 levegő.
7. Amennyiben a trícium használunk?
természetes trícium tartalékok elhanyagolható. Ezért minden trícium, amelyet az iparban használt, mesterségesen előállított. Bombázással neutronokkal lítium atom. A trícium létrehozásához használt a fényérzékeny színezékek, amelyek alkalmazzák a különböző eszközöket. Például, ez látható a fénypor óra értéket, amely a fényt nyilak a sötétben. Stocks trícium emberben elhanyagolható. Mégis, megkapjuk a trícium a szervezetben a levegő és az élelmiszer.
Tríciumgázt 500-szor kevésbé toxikus, mint a trícium, egy részét az extra-nehézvizes az emberi szervezet számára. Ez azért van, mert a gáz halmazállapotú trícium kiválasztódik három percen belül, és a trícium, egy részét az extra-nagy víz, 10 nap után. Így az emberek, akik néha fogyasztanak extra nehézvíz, növeli a sugárzás szintje a szervezetben. Meg kell jegyezni, hogy ha egy ember visel órát, a kéz borítja a foszfor segítségével trícium, 5-ször érzékenyebbek a sugárzásra, mint egy hétköznapi ember.
Az a tény, hogy a hidrogén-három izotópok, nem közötti szétosztását a kémiai elemek. Hidrogén-izotópok különböznek egymástól, és a fizikai és kémiai tulajdonságai. Ez nem tipikus más atomok. Hidrogén-izotópok különböznek egymástól, és a fizikai és kémiai tulajdonságai, mert nagyon különböző tömegű. Tanulmányozása a hidrogén izotópjai, a tudósok arra a következtetésre jutott, hogy a kémiai tulajdonságait az elem kényelmesen tanulmányozzuk a példája az izotópok.
Így született meg egy új terület kémia - a kémia az izotópokat.
8. A mag atom
Az atommagok, amelyek azonos számú neutron, de különböző számú protonok nevezzük izotóniás. Izotóniás. A név „Izoton” alkotta alapján a „izotóp”. Cseréjével "n" (proton) a "n" (neutron). Példák isotones izotópok, és lehet használni. Könnyen kiszámítható, hogy ezekben Izoton 7 neutronokat.
Nuklidokat azonos tömegszámú nevezzük isobar. isobar; stb-grech.ἴσος (ISO-k) - «ugyanazon» + βάρος (Baros) - «w»). Például :. A szám és a protonok és neutronok az izobár más.
Az atommag protonokból, pozitív töltésű, és neutronok nincs töltés. Minden ilyen részecskék 1, és a súlyt. EM A protonok száma és a neutronok a sejtmagban tömegét határozza számát az atom. Ha a protonok száma a sejtmagban állandó, és eltérő számú neutronok, ilyen atomok nevezzük izotópok.
Összefoglalva az eredmény a leckét.
A lecke, amit megismételni, amit egy elemi atom modell, szerkezete hasonló a mi Naprendszerünk. Megtudjuk, mit évben fizikusok megtanulták a tapasztalat Rutherford, ahonnan tevődik össze a sejtmag, a sűrűség, hogyan juthat egy új elemet, hozzáadva a proton.
Az ajánlott olvasás
Ajánlott linkek az online forrásokat
Ajánlott házi
2. Milyen izotópok és isobar Izoton?
3. Listája hidrogén izotópok, nevüket és összetételét.
Loading.
Be kell, hogy töltse le a óravázlatok a témában „A készítmény az atommagok. Isotopes (Chemical Grade 9). tartás kapcsolat
Loading.
Népszerű művek
- Tájképek a dalszövegek S.Pushkina
- Elemzés Blok vers „A területen Kulikovom”
- Apa és fia a történet D. Aldridge „Az utolsó Inch”
- Élete és munkássága Goethe VI
- Döntéseket a választottbíróság. feladatok
- Tervezése vendéglátóipari tervezés étteremben. 2. rész
- A. és S. S.Pushkin A.Esenin orosz természet
-
projekt Statisztika