Hőkapacitás - ez
a hőmennyiség a test által elnyelt hevítve 1 fok (1 ° C vagy 1 K); hogy pontos legyek - az arány a száma által elnyelt hő a test miatt infinitezimális változás annak mértékét-ry, hogy ez a változás. T. egységek. tömeg-WA (R, kg) nevezzük. fajlagos térfogat 1 mol -Szigetek - mol (mól) T. Ed. T. szolgálja J / (kg • K) J / (mol • K), J / (m 3 • K), és az off-rendszer egységek. cal / (mol • K).
Hőmennyiség felszívódik a szervezetben, amikor állapota. Ez nem csak attól függ a kezdeti és a végső állapot között (különösen azok aránya-ry), hanem a módja, hogy szem végeztek az átmenet a kettő között. Ennek megfelelően, a módszer a fűtési függ a test és általában különböztetni a T. T. utáni. térfogat (CV) és a T a poszt. nyomás (cp), ha állandó megfelelően térfogatát vagy nyomás a fűtési folyamat. Végzett melegítéssel a post. nyomás a hő megy a termelés a munka kiterjesztése a test, és néhány -, hogy növelje a belső energia, melegítés közben az üzenet. A kötet az összes hőfogyasztás növelése ext. energiát; ebben a tekintetben, cp mindig nagyobb, mint a cv. A gáz (hígított, hogy azok tekinthetők ideális) különbség vö T. mól-CV = R, ahol R - Univers. gázállandó. egyenlő 8,314 x D / (mol • K), vagy 1.986 cal / (mol • K). A folyadékok és a tv. tel a különbség cp és cv viszonylag kicsi.
A 1. és 2. kezdett termodinamika, hogy av = T (dS / dT) p, és cv = T (dS / dt) v, m. E. T. arányok. származékot az entrópia S a rendszer-ütemű T D megfelelő körülmények között.
Theor. kiszámítása TA különösen attól függően, hogy annak mértéke-ry test nem megvalósítható tisztán termodinamikai. módszereket igényel módszerek alkalmazása a statisztikus fizika (mikroszerkezet tudás cél). T. Gázok kiszámításához csökkenti, hogy a számítás Wed. hőmozgás energia Tsz. molekulákat. Ez a mozgás alkotja postupat. és forgatagában. mozgások egész molekula és a rezgések az atomok molekulán belüli. Szerint a klasszikus. statisztikák postupat minden fokú szabadságot. és forgatagában. mozgások moláris T. (CV) a gáz mennyiségének R / 2, és az egyes kolebat. fokú szabadságot - R; ez a szokás nevezni. ekvipartició törvény. B-ca egyatomos gázok csak három postupat. szabadsági fok, illetve meg kell T. cv 3R / 2 (t hn / k, ahol n -. rezgési frekvencia.
Intervallumok között örvény. az energia szintjét egy kétatomos molekula (osztva k) aránya mindössze néhány. K, és csak az ilyen fényt molekulák például a hidrogén-molekula, elérheti a több száz K. Ezért, amikor a normál sebesség rah-örvény. T. kétértékű rész (többértékű) ekvipartició gáz engedelmeskedik a törvény. Közötti időszakban kolebat. energiaszintet elérheti a több. A több ezer, és így normális ütemben-rah ekvipartició jog nem alkalmazható a kolebat. Kiszámítása a T. T. kvantum statisztikák az a következménye, hogy a kolebat. T. gyorsan csökken csökken tempóban-ry, nullához. Ez magyarázza azt a tényt, hogy még normális ütemben-rah kolebat. T. része gyakorlatilag hiányzik és T. Mol kétatomos gáz 5R / 2 helyett 7R / 2.
Megfelelően alacsony sebességgel-PAX T. általában kell kiszámítani a kvantum statisztikák. Amint kiderült, T. együtt csökken a ráta-ry nullára a T ®0 egyetértésben m. N. Nernst elv (harmadik főtétele).
A TV-t. (Kristályos). Testületek a termikus mozgás atomok egy bizonyos kis rezgések közel egyensúlyi pozíciók (cristae csomópontok. Rácsok). Minden atom rendelkezik m. O. Három kolebat. szabadsági fok, és a, a törvény szerint a ekvipartició, a mol T. TV. Body (. T. cristae rács) egyenlőnek kell lennie 3nR, ahol n - az atomok száma a molekulában. A valóságban azonban ez az érték - az egyetlen korlátozás, hogy a to-rum törekszik T. tv. test nagy ütemben-rah. Elérte a megszokott ütemben-rah sokan mások. elemeket, beleértve a fém (n = 1, T N Dulong és Petit jog ..), hogy y bizonyos egyszerű vegyület (NaCl, MnS (n = 2), PbCl2 (n = 3), stb.) ...; A komplex vegyületek sőt, ez a korlátozás nem érte el, azaz a. k. olvadás előtt lép fel a szigeteken vagy annak bomlási.
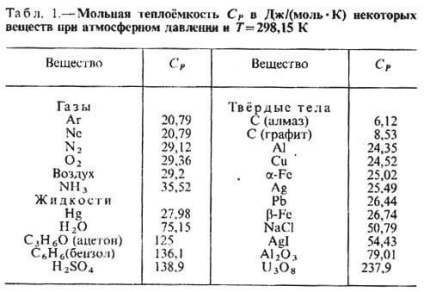
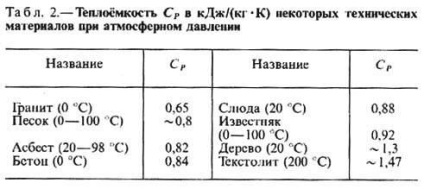
Fajhő cp bizonyos gázok (J / (mol • K), folyadékok és szilárd anyagok (kJ / (kg • K) ATM. Nyomás és t = 25 ° C-on
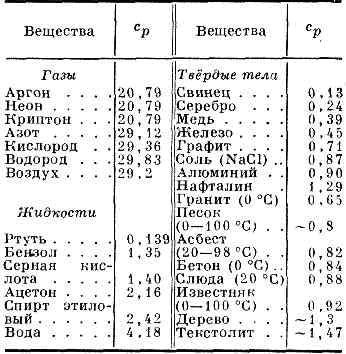
Alacsony temp-rah, a rács komponens T. tv. test menetáttételi. kocka has. szívritmus-ry (Debye hőkapacitása törvény). Az a kritérium, hogy különbséget a magas és az alacsony hőmérséklet-ry, yavl. ezek összehasonlítása a jellemző minden paraméter szigetek - m.
- Száma hő; felszívódik a szervezetben, ha melegítik 1 fok (1 ° C vagy 1 K); hogy pontos legyek - az arány a száma által elnyelt hő a test miatt infinitezimális változás annak mértékét-ry, hogy ez a változás. T. tömege anyag egységei nevezett. fajlagos térfogat 1 mol moláris anyag (mól) T. T. Az egységek J / (kg · K) DzhDmol · K), J / (m 3 · K) és off-rendszer egység cal / (mol · K).
Hőmennyiség szívódik fel a szervezetben, ha annak állapota változik nem csak attól függ a kezdeti és a végső állapot között (különösen azok aránya-ry), hanem a módja, hogy szem végeztek az átmenet a kettő között. Ennek megfelelően, a módszer a fűtési függ a test és általában különböztetni a T. T. utáni. térfogat (CV) és a T a poszt. nyomás (P P), ha a fűtési folyamat tartjuk állandó térfogatú, rendre, vagy a nyomótest. Végzett melegítéssel a post. nyomás a hő megy a termelés a munka kiterjesztése a test, és néhány -, hogy növelje a belső energia, melegítés közben az üzenet. A kötet az összes hőfogyasztás növelése ext. energiát; kapcsán a CP mindig nagyobb, mint a CV. A gáz (hígított, hogy azok tekinthetők ideális) TS moláris különbség P - CV = R, ahol R - az univerzális gázállandó egyenlő 8,314 J / (K · DMOL), vagy 1986 kalDmol · K). A folyadékok és szilárd anyagok közötti különbséget P C és a CV viszonylag kicsi. T. Mivel P egyes anyagok és anyagok táblázatban felsorolt. Az 1. és 2..
Az 1. és 2. termodinamika, hogy m. E. T. arányokat. származékot az entrópia S a rendszer-ütemű T D megfelelő körülmények között.
Elméleti. kiszámítása TA különösen attól függően, hogy annak mértéke-ry test nem megvalósítható tisztán termodinamikai. módszereket igényel módszerek alkalmazása a statisztikus fizika (tudás mikroszerkezetű anyag). T. Gázok kiszámításához csökkenti, hogy a számítás Wed. hőmozgás energia Tsz. molekulákat. Ez a mozgás alkotja postupat. és forgatagában. mozgások egész molekula és a rezgések az atomok molekulán belüli. Szerint a klasszikus. statisztikák postupat minden fokú szabadságot. és forgatagában. mozgások moláris T. (C V) gáz mennyiségének R / 2, és az egyes kolebat. fokú szabadságot - R; ez a szokás nevezni. ravnoraspredeleniyazakonom. Részecske egyatomos gázok csak három postupat. szabadsági fok, illetve, hogy T. V C kell lennie 3R / 2 [m. K) vagy
3 cal / (mol. K)], jó egyezésben a kísérletben. Kétatomos gáz molekula három postupat. Két örvény. és egy kolebat. szabadsági fok, és egyenletes elosztásban jog vezet a értéke CV = 7R / 2. tapasztalat azt mutatja, hogy a T. mól kétatomos gáz (normál ütemben-PAX) 5R / 2 közötti eltérés elmélet és a kísérlet annak a ténynek köszönhető, hogy a számítás a T. figyelembe kell venni a kvantum hatások, azaz. e. felhasználásának kvantum statisztikák. Szerint kvantummechanika, bármilyen rendszer részecskék, amelyek elvégzik oszcilláció vagy elfordulását (t. H. A gáz molekulában) csak meghatározott. diszkrét energia értékeket. Ha az energia hő-mozgás a rendszerben nem elegendő, hogy gerjeszti oszcilláció meghatározva. frekvencia, ezek az ingadozások nem járulnak hozzá a T. rendszer (amely megfelel a szabadságfok „fagyott” - ez nem vonatkozik a törvény ekvipartició). Ideiglenes T-pa, míg elérése egy raj ekvipartició jog alkalmazandó pörögni. vagy kolebat. a szabadságfok határozza meg kvantummechanikai. kapcsolatban, ahol v - ingadozások.
Intervallumok között örvény. az energia szintjét egy kétatomos molekula (osztva k) aránya mindössze néhány. K, és csak az ilyen fényt molekulák például a hidrogén-molekula, elérheti a több száz K. Ezért, amikor a normál sebesség rah-örvény. T. kétértékű rész (többértékű) ekvipartició gáz engedelmeskedik a törvény. Közötti időszakban kolebat. energiaszintet elérheti a több. A több ezer, és így normális ütemben-pax ekvipartició jog nem alkalmazható a kolebat. Kiszámítása a T. T. kvantum statisztikák az a következménye, hogy a kolebat. T. gyorsan csökken csökken tempóban-ry, nullához. Ez magyarázza azt a tényt, hogy még normális ütemben-pax kolebat. T. része gyakorlatilag hiányzik és T. Mol kétatomos gáz 5R / 2 helyett 7R / 2.
Megfelelően alacsony sebességgel-PAX T. általában kell kiszámítani a kvantum statisztikák. Amikor T-> 0 T csökken összhangban m. N. Nernst elv (harmadik főtétele)
A szilárd anyagot (kristályos). Testületek a termikus mozgás atomok kicsi rezgések közelében határoztuk meg. egyensúlyi helyzete (kristályos komponensek. rács). Minden atom rendelkezik m. O. Három kolebat. szabadsági fok, és a, a törvény szerint a ekvipartició, T. moláris szilárd (T. kristályos. rácsokon) egyenlőnek kell lennie W nr. N-, ahol a atomok száma a molekulában. A valóságban azonban ez az érték - az egyetlen korlátozás, hogy a to-rum törekszik T. szilárd test nagy ütemben-pax. Elérte a megszokott ütemben-pax sokan mások. .... A elemek t órán át a fém (n = 1, 3 (Debye jog hőkapacitása) A kritérium különbséget tenni a magas és az alacsony sebesség-Ry jelentése összehasonlítása a jellemző az egyes anyagok a - úgynevezett jellemző .. vagy Debye hőmérséklet qd, Ez az érték határozza meg a spektrumát atomi rezgések a szervezetben, és így jelentős mértékben függ a kristályos. szerkezetét (lásd. a kristályrács rezgéseket). Jellemzően QD -értéke érdekében több. száz K, de lehet olyan magas (pl. gyémánt) és több ezer K,
A fémek meghatározzuk. T. így hozzájárul a vezetési elektronok és (lásd. E hőkapacitás). Ezt a részt a T ki lehet számítani a Fermi - Dirac statisztikát vannak kitéve egy raj elektronokat. E T. a fém arányának. T. Azt azonban, viszonylag kis értékű, hozzájárulását fém T. jelentőssé válik csak akkor, ha a ráta-fő, közel az abszolút nulla (kb több. K), ha, a rács T. (
T 3) válik elhanyagolhatóan kicsi. A kristályos. szervek rendezett elrendezését centrifugálás mágnes. pillanatok az atomok (ferromágneses és antiferromágneses anyagok) létezik kiegészítik. Magnus komponens T. Amikor a tempóban-re a paramágneses fázisban átmenetet. állapotban (a Curie-pont vagy a Neel pont rendre), ez a komponens T. tapasztalható meredek emelkedése - van egy „Rush” T, amely egy jellemző tulajdonsága fázisátalakulások a 2. típusú.
Irod Landau L. D. Lifsic E. M., Statisztikai fizika. 3rd ed. 1. rész, M. 1976 .; Táblázatok fizikai mennyiség. Handbook, szerk. I. K. Kikoina, M. 1976 E. Lifshitz.