Henry törvény - studopediya
A gáz mennyiségét feloldjuk egységnyi térfogatú oldat nazyvaetsyarastvorimostyu: m 3 / m 3 g / l mol / l, stb ...
A oldhatósága gáz a folyadék a képességét határozza meg a tiszta gáz komponenst vagy gázkeverék, így homogén folyékony oldatokat.
A oldhatósága megnő a gáz nyomás növelésével:
F, Hgmm. Art. 102 390 874 1160
g, g / l 10,6 2,74 24,0 31,6
A gáz a magas volatilitása erő nem lehet feloldva a folyadékban, és már egy végtelenül kis koncentráció egyensúly jön létre „oldatot gáz” nem egyszerűen egy oldat, és a telített oldatot egy adott p és T.
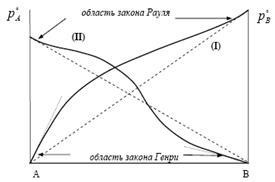
Folyamat ideális gáz oldódási viszonylag alacsony nyomáson. hiányában kémiai kölcsönhatás a gáz egy folyékony, írja le Henry (William uchon.1774-1836 Eng.), nyissa meg őket 1803 évben, mely szerint: „A számos oldott gáz a folyadék egyenesen arányos a nyomással az oldat fölött állandó hőmérsékleten”.
ahol K - állandója Henry, 1 / Pa, 1 / bar, 1 / atm;
p - teljes nyomás, Pa, bár atm.
Abban az esetben, ha a tiszta gáz oldjuk (egy komponenst), a p értéke egyenlő a teljes nyomást. és ha a gázkeverék oldjuk, majd a p értékét fogja jellemezni a parciális nyomás (pi) az oldott gáz a folyékony komponens:
Henry-törvény egy speciális esete az általános törvénye Dalton.
A parciális nyomása a komponens a gázkeveréket képlettel számítottuk ki:
ahol pi - parciális nyomása az i-edik komponense;
P tot - teljes nyomás a gázelegy;
Expression (2) - a kifejezés a Henry-Dalton törvény.
Vg / Vl Þ V2 ® térfogathányada az oldott gáz, ami az ideális gáz egyenlő móltörtje (x2) Þ Ennek következtében az Avogadro-törvény. x2 = KG # 8729; p2.
Kifejezése Henry törvény Dalton írt, mint:
ahol xi - móltörtje az oldott gáz.
Ki - Henry-állandó i-edik gáz komponenst;
pi - parciális nyomása az i-edik gázkomponens a keverékben.
Egyenlet (4) más alakú, amellyel ismerjük, hogy rendkívül híg oldatok (ORS). A valós rendkívül híg oldatok az oldószer (x1) teljesül Raoult törvénye. és az oldott folyékony anyag (x2) - Henry-törvény.
A folyékony oldatok THC folyadékok összehasonlítható nyomások a telített gőzök Henry kísérletesen. Alacsony koncentrációknál a gőznyomása az oldott anyag arányos a móltörtje
gdekG - empirikus állandó (Henry-állandó), amelynek nyomása dimenzió. Ha összehasonlítjuk a kifejezés 5-Raoult törvénye (Mr. Raul Þ ), Akkor ebből az következik, chtokG @
Azonban, az arányossági tényező eltér a telített gőz nyomása tiszta anyag: ¹ kg p o i
Henry-állandó definíció szerint a lejtőn a érintő a kísérleti nyomás görbe összetételétől függően az oldat pár, ha X2 ®0.
Henry konstans határozza meg extrapoláció a kísérleti adatok:
Amikor x2 ®1, kg ® r o 2 és megkapjuk a törvény Raul.
Összehasonlítjuk a két forma (4)
A gyakorlatban, az oldhatóság a gáz általában nem expresszálódik mól frakciói, és térfogategységben az expressziós (1). . (6)
A oldhatósági aránya a nyomás (T = const) a Henry-állandó:
és azt a fizikai értelmében a oldhatósági hányados a gáz parciális nyomása egyenlő egység, 1 bar, 1 MPa, 1 atm.
Mérték a gáz oldhatósága a folyadék oldhatósági együttható (a), amely jelzi az oldott mennyiség a folyékony (oldat) egy gáz hőmérséklete és nyomása adatok (P és T) feltételek:
ahol egy - együtthatója gáz oldhatósága (Bunsen koefficiense), m 3 / m 3.
Az analitikus kifejezés a Henry-törvény termodinamikai módszer származik Gibbs-Duhem:
ahol X1 és X2 - móltörtje az oldószer (1 - folyadék) és az oldott anyag (2 - dioxid);
m 1 és m2 - kémiai potenciálok az oldószer és az oldott anyag.
A kémiai potenciálok lehet meghatározni a következő kifejezések:
ahol P1 és P2 - az oldószer részleges és oldott gáz.
Differenciálás kifejezés (9), a különbségek a kémiai potenciál:
Behelyettesítve expresszió (4.10) az eredeti egyenlet a Gibbs-Duhem (8):
Válassza dlnp2 egyenlet (11):
Ez az egyenlet lehet alakítani ebben a formában:
A parciális nyomása gőz ideális tulajdonságokkal az oldószer lehet meghatározni Raoult törvénye, és kifejezni azt szempontjából telített gőz nyomás:
Differenciálás (14) szerinti x1. . helyettesítésével be (13) kapjuk az alábbi egyenlet szerint:
Vegyük a határozatlan integrál egyenlet (15) bevezetésével az integrációs állandók LNK, ahol Kg - Henry-állandó:
Miután egy potencírozódott kifejezést (4,16) megkapjuk az egyenlet Henry-törvény:
Alapján ez az egyenlet, Henry-törvény azt mondja. „Állandó hőmérsékleten a parciális nyomása illékony (gáz halmazállapotú) komponens (p2) egyenesen arányos a móltörtje a folyékony (x2)”.
Ez a készítmény Henry-törvény vonatkozik arra az esetre, amikor az oldott gáz alakú alakul bo ¢ nagyobb gőznyomás (p o r), mint a gőz nyomása a tiszta oldószer (p o p), ami jellemző a gáz. Ebben az esetben mind az anyag oldatát (gáz és oldószer) kémiailag inert. A dimenzió értékeket kg egyenletben (17) ugyanaz, mint a parciális nyomás.
Az oldhatósági gázok és folyadékok közvetlenül arányos a parciális nyomása a gáz (p) a folyadék felszíne feletti :.
Henry-állandó állandó az i-edik anyag egy adott hőmérsékleten, a hőmérséklet értékének megváltoztatása szerint változik exponenciális törvény. A k különböző rendszerek vannak adva az utalásokat a termodinamikai Az anyagok tulajdonságainak.
Általában a Henry-állandó jellegétől függ a gáz, az oldószer jellegétől és a hőmérséklet.
A nagy nyomás (a fenti 1¸1,2 MPa), vagy ha a gáz tulajdonságaitól tökéletlen oldatot. amely akkor fordulhat elő viszonylag nagy koncentrációban oldott gáz egy oldószerben, tekintve Henry-törvény használunk ahelyett, hogy a nyomás értékek fugacitás:
ahol FG - fugacitás (volatilitás) a gáz;
gf - fugacitás együttható, amely attól függ, hogy p és T.
Chatelier elv. A termodinamikai rendszer egy stabil egyensúlyi állapotból, hatással lehet a külső tényezők, farag ki ez az állapot. A reakció rendszer ezeket a hatásokat minőségileg meghatározható alapján Chatelier-Braun elv javasolt 1884-ben a francia kémikus Henri Lui Chatelier (1850-1936 év), és telepedett le 1887-ben a német fizikus Karl Ferdinand Braun (1850-1918 g x): „a külső hatásokkal, levezeti termodinamikai rendszer egy stabil egyensúlyi állapotból, emiatt áramlási folyamatokat, amelyek csökkentik a hatása ezeknek a külső zavarok.”