Cooperative konformációs változások protomerek - studopediya
O2 kötődik a hemoglobin keresztül promoterok Fe 2+. amely össze van kötve a négy nitrogénatomot a pirrol gyűrű nitrogénatomot és téma
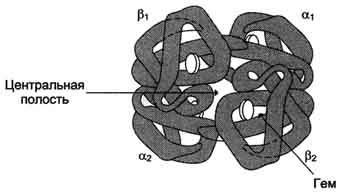
Ábra. 1-32. A szerkezet a hemoglobin.
Giese F8 fehérjét protomer. O2 kötődés Fe 2+ fennmaradó szabad koordinációs kötés a másik oldalán a sík a hem Giese E7 (hasonló módon, mint ez bekövetkezik a mioglobin). Giese E7 nem reagál O2. de ez biztosítja az optimális feltételeket annak kötődési (ábra. 1-33).
A deoxihemoglobin keresztül kovalens kötéssel a protein része atom Fe 2+ kinyúlik a sík a hem irányába Gis F8. Csatlakozási O2 atommal Fe 2+ egy protomer okoz annak elmozdulását a síkjában a hem, majd mozgatásával a maradékot Gis F8 és a polipeptid-lánc, amelyben tartozik. Mivel protomer van csatlakoztatva a másik promoterok és fehérjék rendelkeznek konformációs labilitás, a változás konformációját a teljes protein. Konformációs változások más protomerek, egyszerűsíti a csatlakozást követően O2 molekulára. Ez okozza az új szerkezeti változást a fehérje kötődés és követő gyorsítás O2 molekula. A negyedik O2 molekula kapcsolódik a hemoglobin 300-szor könnyebb, mint az első molekulához (ábra. 1-34).
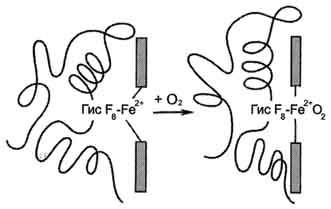
Ábra. 1-33. Változó prlozheniya Fe 2+ és a fehérje része hemoglobin O2 csatlakozásra.
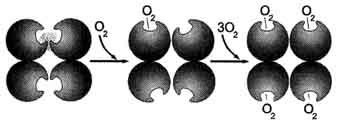
Ábra. 1-34. Cooperative konformációs változások protomerek hemoglobin O2 csatlakozásra.
Szerkezeti változás (és így a funkcionális tulajdonságok) az összes fehérje oligomer protomerek alatt csatlakozási ligandum csak egyikük az úgynevezett kooperatív konformációs változásokat protomerek.
Hasonlóképpen a szöveti disszociációs Minden O2 molekula megváltoztatja az Aa promoterok és megkönnyíti az ezt követő hasításával O2 molekulák.
O2 disszociációs görbéjét mioglobin és a hemoglobin
Kooperativitás hemoglobin promoterok látható görbék disszociációs O2 mioglobin és hemoglobin (ábra. 1-35).
O2 aránya elfoglalt kötőhelyek a fehérje, hogy az összes oldalak képes kötődni, az úgynevezett telítettségi fok ezen fehérjék oxigén. A disszociációs görbék azt mutatják, hogy ezek a fehérjék telített különböző értékei O2 az oxigén parciális nyomása.
O2 disszociációs görbe myoglobin formájában van egy egyszerű túlzás. Ez azt jelzi, hogy a mioglobin reverzibilisen kötődik a ligandumhoz, és nem befolyásolja semmilyen külső tényezők (az alábbi ábrát).
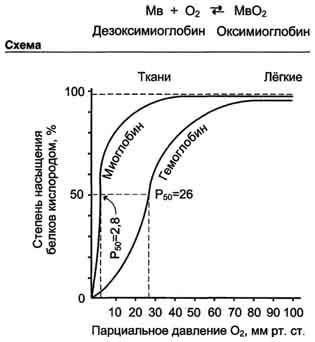
Ábra. 1-35. Oxigén disszociációs görbék mioglobin és hemoglobin függően az oxigén parciális nyomása.
A folyamatok kialakulását és a pusztulás a oxymyoglobin egyensúlyban van, és az egyensúlyi eltolódik a bal vagy a jobb attól függően, hogy oxigént adagolunk, vagy eltávolítjuk a rendszerből. Mioglobin oxigént köt, amelyben a kapillárisok a szövetek felszabadítja a hemoglobin és a mioglobin önmagában felszabadítani O2 válaszul növekedését kereslet rá és az izomszövet intenzív használata során O2 eredményeként fizikai megterhelés.
Mioglobin igen nagy az affinitása a O2. Még parciális nyomású O2. egyenlő 1-2 Hgmm. Art. Mioglobin társított helyzetben marad O2 50%.
O2 disszociációs görbéjét hemoglobin. A grafikonból látható. 1-35 azt mutatja, hogy a hemoglobin sokkal kisebb az affinitása a D2; félig telített O2 hemoglobin bekövetkezik egy nagyobb nyomású O2 (körülbelül 26 Hgmm. v.).
disszociációs görbéjét hemoglobin szigmoid alakú (S-alakú). Ez azt jelzi, hogy a protomerek hemoglobin együttműködnek: a több O2 protomerek adni, annál könnyebben megy hasítás későbbi O2 molekulák.
A nyugvó izom kapillárisok, ahol a nyomás az O2 körülbelül 40 Hgmm. Art. a legtöbb oxigént visszavezetjük részeként oxihemoglobin vissza a tüdőbe. Amikor fizikai munka O2 nyomás a hajszálerek izmok esik 10-20 Hgmm. Art. Ez ebben a régióban (10 és 40 Hgmm. V.) „cool rész” S-alakú görbe, ahol a legnyilvánvalóbb tulajdonsága kooperatív munka protomerek.
Ezért, mivel az egyedülálló szerkezete az egyes vizsgált fehérjék végrehajtására alkalmasan van kialakítva a funkcióját: mioglobin - kapcsolódó O2. felszabadult hemoglobint a sejtben felhalmozódnak, és engedje vészhelyzet esetén; hemoglobin - kapcsolódó O2 a tüdőben, ahol eléri a telítési 100% és az O2, hogy a kapillárisok a szövetek függően nyomás változás abban az O2
4. Transfer H + és C02 a szövetekből a tüdőbe
segítségével hemoglobin. Bohr hatás
Oxidációja szerves vegyületek energiát előállítani fordul elő a mitokondrium sejtek alkalmazásával O2. által szállított hemoglobin a tüdőbe. Ennek eredményeként a oxidációja anyagok előállított végső bomlástermékek - CO2 és H2 O, a száma, amely arányos a intenzitása oxidációs folyamatok. CO2. kialakítva a szövetekben, ez szállítják vörösvérsejtekben. Ott, az intézkedés alapján az enzim fordul elő karbangidrazy növeli a képződési sebességét H2 CO3. Gyenge szénsav lehet disszociál HCO3- és H + -
Egyensúlyi reakciók eritrocitákban, amelyek a kapillárisok a szövetek, jobbra tolódott, mint eredő disszociációs szénsav protonok lehet csatolni meghatározott részeinek a hemoglobin molekula: a gyökök Gis146 -lánca két, gyökök Gis122 terminális aminocsoportot és két -lánca ???. Mindezek a hat részletben átmenet hemoglobin hidroxil- dezoxi szerezni nagyobb az affinitása az N + eredményeként helyi változást az aminosav körüli környezet ezek a helyek (megközelítve őket negatív töltésű karboxilcsoportjai aminosavak).
Joining három pár protonok hemoglobin csökkenti az affinitását a O2 és O2 javítja a szállítási a szövetekbe megkövetelésével (ábra. 1-36, A). A növekedés a felszabadulását O2 hemoglobin által koncentrációjától függően a H + nevezzük Bohr hatás (elnevezett dán fiziológus Christian Bohr, fedezték ezt a hatást).
A tüdő kapillárisokban magas O2 parciális nyomása eltávolítását eredményezi a hemoglobin oxigenizációt és 6 protonok. Reakció CO2 + H2 O - H2 CO3 - H + + HCO3 - balra tolódott, és a kapott CO2 szabadul az alveoláris térbe, és eltávolítjuk a kilélegzett levegő (ábra 1-36, B.). Következésképpen a hemoglobin molekula az evolúció során szerzett képes érzékelni és reagálni a kapott információkat a környezetet. Fokozott proton koncentrációja a közegben csökkenti az O2 hemoglobin affinitását, és fokozzák a szállítás a szövetbe (ábra. 1-37).
A legtöbb CO2 szállítása a vérben formájában hidrogén-karbonát HCO 3 -. kis
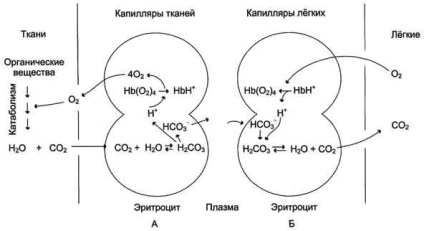
Ábra. 1-36. Az átadás a H + és CO2 a vérből. Bohr hatás. A - hatására koncentrációja H + és CO2 O2 felszabadulását a komplexet a hemoglobin a szövetben (a Bohr hatás); B - desoxyhemoglobin oxigenizáció a tüdőben, képződését és felszabadulását a CO2.
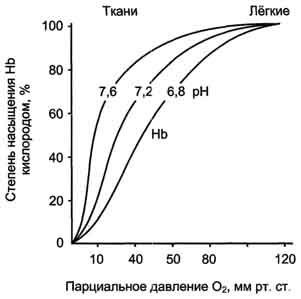
Ábra. 1-37. A pH hatása az O2 disszociációs görbéjét hemoglobin.
CO2 (15-20%) átvihetők a tüdőbe, reverzibilisen csatlakozott a nem ionizált terminális a-amino-csoport. R-NH2 + CO2 = R-NH-COO + H +. az eredmény egy karbogemoglobin, ahol R - polipeptid-lánc a hemoglobin. Összefogás CO2 hemoglobin és csökkenti az affinitását a O2.
5. 2,3-Bifosfoglitserat - allostertesky affinitást szabályozót hemoglobin O2
2,3-Bifosfoglitserat (BFG) - olyan anyag szintetizált eritrocitaképződést köztes oxidációs terméke 1,3-bifosfoglitserata glükóz.