Benzol-molekula - hivatkozási vegyész 21

Bifenil. Hőstabilitás bifenil valamivel magasabb, mint a benzol. Ez várható, mivel a stabilizáció miatt 8 bifenil kalóriát rezonancia energia mellett azt, ami során kapott kialakulását két különböző molekulák benzol. Tilicheev [45] megállapította, hogy a sebességi állandó a bomlása bifenil 500 ° C-on 20-szor jobb, mint az bomlása naftalin. és hogy a stabilitás a benzol bifenil közeledő stabilitást. Grinsfelder és mások [14] arról számoltak be, hogy gyakorlatilag bifenil bomlás érintkezve alumínium-cirkónium-szilícium-katalizátor 550 ° C-on nem következik be. Meyer és Hoffman [27] megállapította, hogy a még mindig magasabb hőmérsékleten kapjuk 4,4-difenil-bifenil. [C.97]
De benzol írhat egy második, teljesen egyenértékű Kekulé formula. ahol az egyszerű és kettős kötések cserélték, mint az első képlet. Valódi benzol molekulát le, mint egy rezonancia hibrid két struktúra Kekulé elektronok képződéséért felelős a kettős kötések. delokalizált, kent a gyűrűt, úgy, hogy az összes kötés a szénatomok közötti, a benzol egyenlő, és átmenetet képez a klasszikus egyszeres és kettős kötések. Ez az oka a fokozott stabilitás és jellemzői a kémiai viselkedése benzol. [C.162]
Hidrogénezése ezen polifenilén szénhidrogének végezhetjük két különböző módon vagy a hidrogénezett gyűrűt azok elpusztítása nélkül a benzol-molekula (ez esetben gidryurov) vagy Provo di eléggé mélyek hidrogénezés bomlás, így például, a naftalin-molekula két benzol molekula (ez történik a hidrogénezés alatti nagy nyomás a Bergius folyamat). [C.404]
Ábra. 53. Hely p-elektron-CIÓ a felhők a benzol molekula
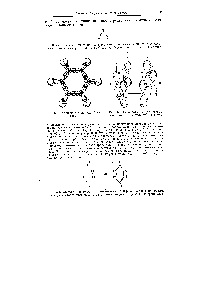
P. 54. I-kötvények a benzol molekula [c.80]
Ábra. 131. reakcióvázlat a kötések egy molekulában benzol
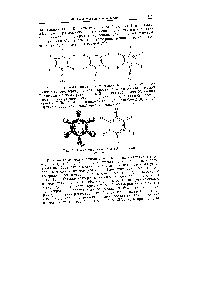
Azonban, a képlet a benzol. Kekulé javasolt, hogy nem alkalmas hnmnkov szerves. Az a tény, hogy sok tekintetben a benzol molekula úgy viselkedik, mintha nem, és nem volt kettős kötést tartalmaznak. (Elvégre a kettős kötések volna, hogy aktívabb benzol. Mint ciklohexán, nem kevésbé aktív.) A végén, a modern elmélet Az anyag szerkezetéről hagyjuk többé-kevésbé kielégítően megoldani ezt a rejtélyt. Ők túl bonyolult ahhoz, hogy menjen be itt érdemes csak a SKA, azt mutatják, hogy azok foglalkoznak részleges vagy frakcionált kötvények. Meg lehet tekinteni. hogy a szénatomok a benzolgyűrű kapcsolódó hat azonos sesquioxides kötést. amelyek kevésbé aktív, mint a kettős, sőt egyszerű. [C.56]
P Egy további példaként egy olyan rendszert, delokalizált kötést úgy vélem molekula benzol SvNv. Ez alakú sík hatszög, [c.79]
I és szabad L-szétesést molekulapályák. Amint uanee (lásd. Ábra. 54), benzolban molekulában 2p elektron hat szénatomot (.brazuyut nelokalizoaannuyu n-kötést. Az elmélet szerint a molekulapályák ez az ábrázolás megfelel a megjelenése a hat atomi 2p -srbitaley hat L-molekulapályák, három IE amelyek kötelező, a másik három - szétesést elősegítő [c.520]
A molekulák benzol és alkilcsoporttal helyettesített közötti kötési energiát a szénatom a gyűrűben, és a hidrogén a Conoco - tavima erejével C. -H -bond metán, és az energia elválasztása hidrogén szén, konjugálva egy aromás gyűrű. lényegesen alacsonyabb, mint az energia a C-H -bond a alkánok. [C.14]
Ehelyett kezdjük rassmotregaya szimmetriája benzol molekula. Tudtuk, hogy egy másik modell a molekula. amelyek többsége kompatibilis a rendelkezésre álló információkat a molekulában. korábban kapott. Ezért folytassa közvetlenül a modell, hogy úgy tűnik a legmegfelelőbbnek. Ebben a modellben, a szénatomok találhatók a sarkokban egy sík szabályos hatszög, és a hidrogénatomok - ugyanabban a síkban lniyah amelyek felezik a szög vegyérték szénatom. Ez a modell egy magas fokú szimmetriát a következő elemeket a hatodik szimmetriatengely, a harmadik és a második sorrendű. szimmetria síkban. ATCM áthaladó és a -C-C kötés, egy szimmetriasíkkal. amely tartalmazza a molekula, valamint egy központja szimmetria. [C.302]
Esln identifitsirsvany összes aktív alapfrekvenciája benzol. A kilenc inaktív rezgésekkel még f bizonytalanságok. Ezt a problémát meg lehet oldani olyan megfelelő matematikai számítások. Tekintsük most az alkalmazása ezen megfontolások, egy benzol- molekula. Ábra. 3, hogy a fluktuáció a benzol molekula lehet képviseli alkalmazásával hat különböző típusú belső koordinátái vegyérték deformáció és a deformáció egy síkban társított kimeneti síkban a molekula a C-C és a C-H kötést. Mindegyik koordináták társul egy bizonyos erő állandó. Wilson [12] a következő jelölés tstsel ezekre erőállandók [c.304]
Shtokmeyer kérte a vizsgálatot a rendszer. vinil-acetát és a benzol, nyomjelző módszer. Azt találtuk, hogy a polimer lánc a polimer molekulák benzol 20 azt javasolta, hogy ezt a is előfordulhat kopolimerizációs reakciót (lásd. Alább) [141]. Tény, az egész problémát a támadás a gyökök az aromás rendszer jelenleg nevyyasneshshm részén gyökös kémia. [C.126]
A módszer a molekulapályák. Molekulapályák komplex vegyületek képződnek ugyanazon nriitsinu és ugyanolyan tulajdonságokkal, mint a molekuláris orbitális egy kétatomos molekula (lásd. 45.). A különbség abban rejlik,. az, hogy a komplex vegyületek a beállított MO-gotsentrovymi, delokalizált, hasonló ahhoz, amit történik iaprimer benzolban molekula (lásd. 167). [C.600]
Difenil kapunk, ha Berthelot piroteneticheokom bomlás-ning-benzol (eredményét ábrázolja a dehidrogénezési reakció ooafMvozhdashoy kondenzációját két molekula benzol. [C.396]