Hogyan kell kitölteni az elektronikus szint, sublevels és pályák, mint a komplexitás és az atom
Beszéd szigorúbban, a relatív helyét a sublevels okozza nem annyira a több vagy kevesebb energiát, mint a minimális követelmény, hogy az összes energia az atom.
A eloszlása atomi pályák elektronok bekövetkezik, mivel orbitális a legkisebb energia (energia minimum elve), azaz Úgy ül az elektron legközelebb a sejtmagba orbitális. Ez azt jelenti, hogy az első alrétegek töltve elektronokkal, amelyre a értékek összegét a kvantum számok (n + l) minimalizálható. Mivel az elektron energia a 4s-szintalatti kisebb az elektron energia található a 3d-szintalatti. Következésképpen, az elektronok kitöltésével sublevels a következő sorrendben: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d
4f <6p <7s <6d
Ennek alapján ezt a követelményt, a minimális energia érhető el a legtöbb atomok, amikor azokat töltik sublevels a előbbiekben bemutatott szekvencia. De vannak kivételek, amely megtalálható a táblázatokban „Electronic konfigurációs elemek”, de ezek a kivételek ritkák kell figyelembe venni, ha figyelembe vesszük, hogy kémiai tulajdonságait elemekkel.
króm-atom nincs elektronszerkezet 3d 2 4S 4. Egy 1 4s 3d 5. Ez egy példa arra, hogyan a stabilizációs feltételeket párhuzamos elektron forog csekély különbség elsőbbséget élvez az energia Államokból sublevels 3D és 4S (Hund szabály), amíg az energetikailag kedvező a Államok d-d alréteg 5, és d 10. Az energia diagramja vegyérték sublevels atomok a króm és a réz mutatja ris.2.1.1.
Egy ilyen átmenet egy elektront szintalatti az s-d-alréteg megjelennek, akár 8 elemeket: Cu, Nb, Mo, Ru, Ag, Pt, Au. A átmeneti atom Pd két s-elektronok d-alréteg: Pd 5s 0 10 4d.
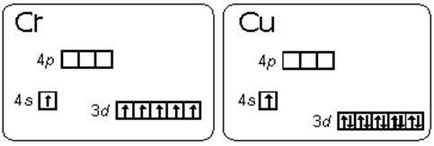
Ris.2.1.1. Az energia diagramja vegyérték sublevels atomok a króm és a réz
Szabályzata megtöltése elektronhéjak:
1. Először is megtudja, hogy hány elektron atom elemeit tartalmazza az érdeklődés. Erre a célra elegendő tudni, hogy a díj a mag, ami mindig egyenlő a sorszáma az elem a periódusos rendszer Mengyelejev. Sequence száma (a protonok száma a sejtmagban), és pontosan megegyezik az elektronok száma körül az atom.
2. Egyenletesen töltse pályák kezdve a 1s-orbitális elektronok rendelkezésre, figyelembe véve azt az elvet, minimális energia. Így lehetetlen, hogy minden egyes orbitális több mint két elektron ellentétes pörgetés (tipikusan Pauli).
3. Írja be a képlet elektronikus elem.
Atom - egy komplex, dinamikus stabilitás Micro kölcsönható részecskék: protonok p +. neutronok n 0 és elektronok e -.
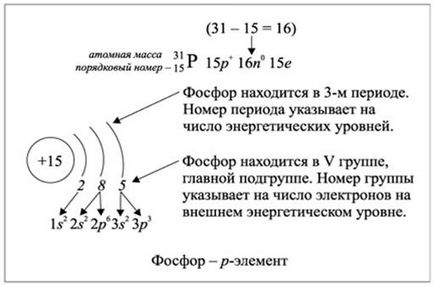
Ris.2.1.2. Kitöltése az energiaszintek elektronok foszfor elem
Elektronikus szerkezet a hidrogénatom (z = 1) lehet az alábbi képlettel ábrázolható:
+1 H-1s 1. n = 1 ↑, ahol a kvantum doboz (atomi) jelöli, egy vonal vagy egy négyzet, és az elektronok - formájában nyilak.
Mindegyik atomot ezt követő kémiai elem a periódusos egy sok-elektron atom.
Lítium atom, valamint a hidrogén és a hélium, azt az elektronikus szerkezetét s-elem, például a utolsó elektron a lítium-atom „ül” a s-szintalatti:
A bóratom jelenik meg először elektron a p-állam:
Rögzítése elektronikus képletű könnyebb megmutatni egy konkrét példát. Tegyük fel, hogy meg kell találni a képlet elektronikus elem a sorszám 7. A atomja a 7 elem legyen az elektronok. Töltsük az orbitális elektronok család, kezdve az alsó 1s-orbitális.
Tehát, 2 elektronok lesz található az 1s-orbitális, az elektron még 2 - on 2s-orbitális, az elektron és a fennmaradó 3 elhelyezésére három 2p-pályák.
Elektronikus képletű elem egy sorszám 7 (ez az elem a nitrogén, amely az „N”) a következő:
Tekintsük a fellépés szabályok Gunda például nitrogénatom: N 1s 2s 2 2 2p 3. 2. elektronikus szinten három azonos p-pályák: 2px, 2py, 2pz. Az elektronok lakják, úgy, hogy minden ilyen p-pályák lesz egy elektron. Ezek szerint ez annak köszönhető, hogy az elektronok a szomszédos sejtek kevesebb, taszítják egymást, mint ugyanolyan töltésű részecskék. Az eredményül kapott elektronikus kapcsolati képletű nitrogén hordoz fontos információkat: 2. (külső) elektronikus nitrogén szinttel van töltve elektronok nem ér véget (ennek 3 + 2 = 5 vegyérték elektron), és, hogy teljesen kitöltse a hiányzó három elektronok.
Külső szinten nevezett atom legtávolabb a magréteg, amelyek vegyérték elektronok. Ez az a héj van érintkezésben egy ütközés külső rétegek más atomok kémiai reakciókban. Amikor kölcsönhatásba lépni egy másik nitrogénatommal tudja fogadni egy elektron 3 további annak külső réteg. Ahol a nitrogénatomhoz kap egy teljes, azaz maximálisan töltött külső elektron szintet, amelyet található 8 elektronokat.
Teljes szinten energetikailag kedvező haladást, így a nitrogénatom kell könnyen reagálnak a bármely más atom, amely képes biztosítani, hogy azt 3 plusz elektron, hogy befejezze a külső réteg.
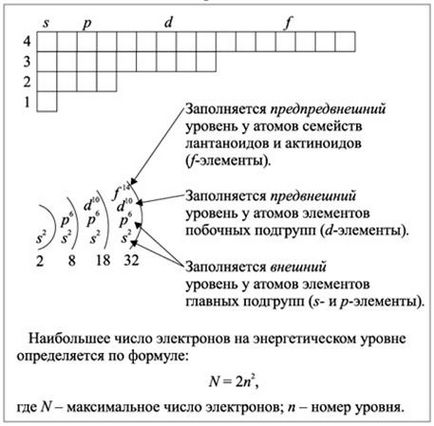
Ris.2.1.3. Kitöltése az energia szintjét a s-, p-, D- és F-elemei elektronok