Vas-szulfát (III)
Vízmentes vas-szulfát (III) - világossárga paramágneses nagyon higroszkópos kristályok monoklin kristály rendszer. tércsoport P21 / m, az egységcella paramétereit az a = 0,8296 nm, b = 0,8515 nm, c = 1,160 nm, β = 90,5 °, Z = 4 Van bizonyíték arra, hogy a vízmentes vas-szulfát alkotja rombos és a hexagonális módosítást. Vízben lassan oldódik etanolban [meghatározott].
Kristályosodik víz formájában kristályos Fe2 (SO4) 3 · N H2 O, ahol n = 12, 10, 9, 7, 6, 4, 3, 1. A legtöbbet tanulmányozott kristályos - nonahidrátot vas-szulfát (III) Fe2 (SO 4) 3 · 9H2 O - sárga kristályok hexagonális elemi cella paraméterek a = 1,085 nm, c = 1703 nm, Z = 4 Ez könnyen oldódik vízben (440 g 100 g vízben) és etanol (absz.). A vizes oldatok a vas-szulfát (III) a hidrolízis miatt válik vörös-barna színű.
Hevítve nonahidrát alakítjuk át 98 ° C-on a tetrahidrát, 125 ° C-on - és a monohidrát 175 ° C-on - vízmentes Fe2 (SO 4) 3. amely 600 ° C felett bomlik, Fe2 O3 és SO3.
Mivel a természetben
Ásványtani formájában vas-szulfát (III) - mikasait (Engl mikasaite.), A vegyes alumínium-vas-szulfát. A kémiai képlet - (Fe 3+ Al 3+.) 2 (SO 4) 3. Ez az ásványi anyag tartalmaz vas-szulfátot, vízmentes formában, így megtalálható a természetben nagyon ritka. Hidratált formák gyakrabban fordulnak elő, mint például:
- Coquimbo (Engl coquimbite.) - Fe2 (SO4) 3 · 9H2 O - nonahidrát - a leggyakoribb formája a természetben.
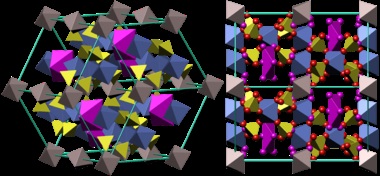
Kristályszerkezet kokimbita
- Parakokimbit (angol paracoquimbite.) - a másik nonahidrát - egy ritka formája.
- Cornelia (született kornelite.) - heptahidrát - és kuenstedtit (angol quenstedtite.) - dekahidrát - túl ritka.
- Lausenit (angol lausenite.) - hexa- vagy pentahidrát (függetlenség az ásványi kérdéses).
Az összes fent említett természetes hidrátjai vas a föld felszínén instabil. De a készletek folyamatosan feltöltik az oxidáció következtében egyéb ásványi anyagok (főként pirit és markazit).
Az iparban, a vas-szulfát (III) volt kalcinálással előállított pirit és markazit NaCi a levegőben:
2 F E S 2 + 2 N a C l + 8O 2 ⟶ F E 2 (SO 4) 3 + N 2 SO 4 + C l 2 + 2NaCl + 8O_ \ longrightarrow Fe_ (SO _) _ + Na_SO_ + Cl_> >>
vagy oldott vas-oxidot (III) kénsavban:
F e 2O 3 + 3 H 2 S O 4 ⟶ F E 2 (S O 4) 3 + 3 H 2 O O_ + 3H_SO_ \ longrightarrow Fe_ (SO _) _ + 3H_O >>>
A laboratóriumi gyakorlatban, vas-szulfát (III) lehet beszerezni vas-hidroxid (III):
2 F e (O H) 3 + 3 H 2 S O 4 ⟶ F E 2 (S O 4) 3 + 6 H 2 O + 3H_SO_ \ longrightarrow Fe_ (SO _) _ + 6H_O >>>
2 F E S O 4 + H 2 S O 4 + 2 H N O 3 ⟶ F E 2 (S O 4) 3 + 2 N O 2 + 2H 2O + H_SO_ + 2HNO_ \ longrightarrow Fe_ (SO _) _ + 2NO_ + 2H_O >>>
Az oxidációt végezhetjük továbbá oxigén- vagy kénatom oxid:
12 F e SO 4 + 3 O 2 ⟶ 4 F E 2 (SO 4) 3 + 2 F e 2O 3 + 3O_ \ longrightarrow 4Fe_ (SO _) _ + 2Fe_O _ >>> 2 F e SO 4 + 2 SO 3 ⟶ F e 2 (SO 4) 3 + SO 2 + 2SO_ \ longrightarrow Fe_ (SO _) _ + SO _ >>>
A koncentrált kénsav és salétromsav oxidált vas-szulfidot vas-szulfát (III):
2 F E S + H 2SO 4 + 18 HNO 3 ⟶ F E 2 (SO 4) 3 + 18 NO 2 ↑ + 10 H 2 O SO_ + 18HNO_ \ longrightarrow Fe_ (SO _) _ + 18NO_ \ uparrow + 10H_O >> >
Vas-diszulfid lehet oxidált tömény kénsav:
2 F E S 2 + 14 H 2 S O 4 ⟶ F E 2 (S O 4) 3 + 15 S O 2 ↑ + 14 H 2 O + 14H_SO_ \ longrightarrow Fe_ (SO _) _ + 15SO_ \ uparrow + 14H_O >>>
Ammónium-vas-szulfát (II) (Mohr-só) is oxidálhatjuk kálium-dikromát. Mivel ez a reakció látszanak egyszer négy-szulfát - vas (III), króm (III). ammónium-és kálium. és víz:
6 F e (NH 4) 2 (SO 4) 2 + 7 H 2SO 4 + K 2 C r 2 O 7 ⟶) _ (SO _) _ + 7H_SO_ + K_Cr_O_ \ longrightarrow >>> F E 2 (SO 4) 3 + C R 2 (SO 4) 3 + 6 (NH 4) 2SO 4 + K 2SO 4 + 7 H 2 O (SO _) _ + Cr_ (SO _) _ + 6 (NH _) _ SO_ + K_SO_ + 7H_O> >>
vas-szulfát (III) állíthatjuk elő, mint az egyik a termikus bomlástermékek vas-szulfát (II):
6 F E S O 4 → T F E 2 (S O 4) 3 + 2 F e 2O 3 + 3 S O 2
Ferrates híg kénsavval csökken a vas-szulfát (III):
4 K 2 F e O 4 + 10 H 2 S O 4 → 2 F e 2 (S O 4) 3 + 3 O 2 ↑ + 4 K 2 S O 4 + 10 H 2 O FeO_ + 10H_SO_
Amikor hőmérsékletre melegítjük pentahidrát 70-175 ° C-on olvad, vízmentes vas-szulfát (III):
X e O 3 + 3 H 2SO 4 + 6 F e SO 4 ⟶ 3 F E 2 (SO 4) 3 + X e ↑ + 3 H 2 O + 3H_SO_ + 6FeSO_ \ longrightarrow 3Fe_ (SO _) _ + Xe \ uparrow \ + 3H_O >>>
vas-szulfát (III) vizes oldatban hidrolízisnek vetjük alá egy erős kation, ahol az oldatot színezett vöröses-barna színű:
F e [(H 2 O) 6] 3 + + H 2 O ⇄ F e [(H 2 O) 5 (O H)] 2 + + H 3 O +; p K = 2. 17 O) _] ^ + H_O \ rightleftarrows Fe [(H_O) _ (OH)] ^ + H_O ^;
p> = 3,26 >>> [2 F e (H 2 O) 6] 3 + 2 + H 2O ⇄ [F E 2 (H 2 O) 8 (OH) 2] 4 + 3 H 2 O +; p K = 2. 91 O) _] ^ + 2H_O \ rightleftarrows [Fe_ (H_O) _ (OH) _] ^ + 2H_O ^;
Forró víz vagy gőz bomlanak vas-szulfátot (III):
Vízmentes vas-szulfát (III) bomlik melegítés:
Alkáli oldatok elbomlanak vas-szulfát (III), a reakció termékei koncentrációjától függ lúg:
F E 2 (SO 4) 3 + 2 N egy OH ⟶ 2 F e SO 4 (OH) ↓ + N 2 SO 4 (SO _) _ + 2NaOH \ longrightarrow 2FeSO_ (OH) \ downarrow + Na_SO _ >>> F e 2 (SO 4) 3 + 6 N egy OH ⟶ 2 F e O (OH) ↓ + 3 N 2 SO 4 + 2 H 2O (SO _) _ + 6NaOH \ longrightarrow 2FeO (OH) \ downarrow + 3Na_SO_ + 2H_O >>>
Ha az alkáli reagáltatjuk ekvimoláris vas-szulfát oldat (III) és a vas (II), az eredmény egy komplex vas-oxid:
F E 2 (SO 4) 3 + F e SO 4 + 8 N egy OH ⟶ F E 3 O 4 ↓ + 4 N 2 SO 4 + 4 H 2O (SO _) _ + FeSO_ + 8NaOH \ longrightarrow Fe_O_ \ downarrow + 4Na_SO_ + 4H_O >>>
Aktív fémek (..., például magnézium, cink, kadmium, vas) redukált vas-szulfát (III):
F E 2 (S O 4) 3 + F e ⟶ 3 F E S O 4 (SO _) _ + Fe \ longrightarrow 3FeSO _ >>>
Néhány fém-szulfidok (.... Például, a réz, ólom-kalcium-ón higany) vizes oldatban csökkentett vas-szulfátot (III):
C u S + F E 2 (S O 4) 3 ⟶ 2 F E S O 4 + C u S O 4 + S (SO _) _ \ longrightarrow 2FeSO_ + CuSO_ + S >>>
formák oldhatatlan vas-foszfát (III) az oldható sók az ortofoszforsav (heterozigótaság):
F E 2 (SO 4) 3 + 2 N H 2 PO 4 ⟶ N 2 SO 4 + 2 H 2SO 4 + 2 F e PO 4 ↓ (SO _) _ + 2NaH_PO_ \ longrightarrow Na_SO_ + 2H_SO_ + 2FePO_ \ downarrow >>>
- Reagensként során hidrometallurgiai feldolgozása réz ércek.
- Mivel a véralvadásgátló a szennyvíztisztító, kommunális és ipari hulladékok.
- Ennek maró festésre szövet.
- Ha a barnulás a bőr.
- Pácolás ausztenites rozsdamentes acél, arany ötvözetek alumínium.
- Ennek flotációs szabályozó csökkenti a felhajtóerőt az ércek.
- A gyógyászatban is használják, mint egy fanyar és vérzéscsillapító.
- A vegyiparban, mint egy oxidálószer és egy katalizátor.